QUIMICA ORGANICA
T.J THOMPSON
LIMUSA
1997
PRINCIPIOS DE QUIMICAINORGANICA
BROWN
IBEROAMERICANA
2006
QUIMICA
ANTONIO RICO
UNAM 2010
lunes, 7 de mayo de 2012
domingo, 6 de mayo de 2012
MI DIETA
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS
CARBOHIDRATO
Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas,
Azucares, helados.
LIPIDOS
GRASAS
ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite,
PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas
VITAMINAS
Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras
FIBRAS
Aceleración del proceso digestivo 25g Cereales y verduras
MINERALES
Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS CARBOHIDRATO Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas, Azucares, helados. LIPIDOS GRASAS ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite, PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas VITAMINAS Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras FIBRAS Aceleración deh proceso digestivo 25g Cereales y verduras MINERALES Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS CARBOHIDRATO Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas, Azucares, helados. LIPIDOS GRASAS ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite, PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas VITAMINAS Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras FIBRAS Aceleración deh proceso digestivo 25g Cereales y verduras MINERALES Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.

LIPIDOS
Clasificaciones y estructuras.
Los mono y diglicéridos se encuentran en cantidades escasas. Aunque un triglicérido puede estar integrado por tres moléculas idénticas de ácidos grasos, también puede estar formada por tres ácidos grasos diferentes. La mayor parte de los ácidos grasos proviene de la hidrólisis de las moléculas de triglicéridos. Las enzimas que catalizan esta reacción en las células, se llaman esterasas o más específicamente lipasas. Las grasas neutras con alto contenido de ácidos grasos insaturados son líquidas, como los aceites comestibles. Si predominan los saturados, las grasas son sólidas, como sucede con las mantecas y las margarinas. Por cada gramo de grasaque se oxida, se obtienen nueve calorías, mientras que sólo se obtienen cuatro calorías al oxidar un gramo de carbohidratos o proteínas. Los fosfolípidos.
Los fosfolípidos o fosfoglicéridos aparecen casi exclusivamente en las membranas celulares, sólo una pequeña parte se encuentra en los depósitos de grasa. Los fosfolípidos tienen cierto parecido estructural con las grasas, prque están compuestos por una molécula de glicerol que tiene dos moléculas de ácidos grasos esterificadas; en lugar del tercer ácido graso se encuentra una molécula de ácido fosfórico. El glicerol, los ácidos grasos y el ácido fosfórico, forman el ácido fosfatídico. Los fosfolípidos deben su naturaleza anfifílica porque tienen una zona polar, representada por el glicerol, el ácido fosfórico, y la otra molécula; y otra zona apolar, constituida por las cadenas de átomos de carbono. La porción apolar es rechazada y la porción polar es atraída por el agua.
COMO AFECTA EL CALOR
***Cómo afecta el calor a...
Sustancias orgánicas: (pan, azúcar, harina) Sustancias inorgánicas (sal, agua) Estas sustancias se clasifican en orgánicas e inorgánicas, ya que en mi opinión las que se queman o contienen cargón son orgánicas, y las que no lo contienen son inorgánicas. Observaciones: El pan, el azúcar y la harina, con el calor se quemaron, unos más que otros, y otros más rápido, pero se queman debido al carbón. En la sal y el agua, como la primera es un mineral y la segunda no tiene carbón, no se queman, pueden cambiar de estado, pero químicamente son las mismas. Conclusiones: Para ser una sustancia orgánica se necesita quemarse, sino, será inorgánica, en éso radica la importancia del conocimiento de las mismas.

OXIDACIÓN Y REDUCCIÓN. Debido a la importancia de los procesos de pérdida y ganancia de electrones, éstos reciben nombres especiales. -La pérdida de electrones por un átomo o ion se llama oxidación -La ganancia de electrones por un átomo o ion se llama reducción Estos dos procesos siempre ser verifican al mismo tiempo. La pérdida y la ganancia de electrones son sólo los resultados de la transferencia de electrones. Las reacciones que implican la transferencia de electrones se llaman a menudo reacciones redox. la palabra redox es la abreviatura de reducción-oxidación Algunas veces una reacción particular recibe el nombre de oxidación o reducción; por ejemplo, la reacción: 2Ca(s)+O2(g) → 2Ca2+(s) +2O2-(s) puede llamarse oxidación del calcio. Esto no significa que no se efectúe la reducción. Significa que al químico le interesa más lo que sucede con los átomos de calcio. Por lo general, cuando un metal reacciona con oxígeno u otro no metal reactivo, la red metálica pierde electrones, de modo que el metal se oxida. En la reacción anterior, el calcio se oxidó. En la reacción siguiente, se oxida el magnesio: Mg(s)+Cl2(g) →Mg2+(s)+2Cl-(s) Del mismo modo un no metal se reduce cuando reacciona con un metal: los átomos del no metal ganan electrones. En los dos últimos ejemplos se redujeron el oxígeno y el cloro. COMBUSTIÓN La combustión es una reacción química en la cual, generlamente se desprende una gran cantidad de calor y luz. En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente) el cual es generalmente oxígeno en forma de O2 gaseoso. En una reacción completa todos los elementos tienen el mayor estado de oxidación. En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas. Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define comk, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente. La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión. .
Sustancias orgánicas: (pan, azúcar, harina) Sustancias inorgánicas (sal, agua) Estas sustancias se clasifican en orgánicas e inorgánicas, ya que en mi opinión las que se queman o contienen cargón son orgánicas, y las que no lo contienen son inorgánicas. Observaciones: El pan, el azúcar y la harina, con el calor se quemaron, unos más que otros, y otros más rápido, pero se queman debido al carbón. En la sal y el agua, como la primera es un mineral y la segunda no tiene carbón, no se queman, pueden cambiar de estado, pero químicamente son las mismas. Conclusiones: Para ser una sustancia orgánica se necesita quemarse, sino, será inorgánica, en éso radica la importancia del conocimiento de las mismas.

OXIDACIÓN Y REDUCCIÓN. Debido a la importancia de los procesos de pérdida y ganancia de electrones, éstos reciben nombres especiales. -La pérdida de electrones por un átomo o ion se llama oxidación -La ganancia de electrones por un átomo o ion se llama reducción Estos dos procesos siempre ser verifican al mismo tiempo. La pérdida y la ganancia de electrones son sólo los resultados de la transferencia de electrones. Las reacciones que implican la transferencia de electrones se llaman a menudo reacciones redox. la palabra redox es la abreviatura de reducción-oxidación Algunas veces una reacción particular recibe el nombre de oxidación o reducción; por ejemplo, la reacción: 2Ca(s)+O2(g) → 2Ca2+(s) +2O2-(s) puede llamarse oxidación del calcio. Esto no significa que no se efectúe la reducción. Significa que al químico le interesa más lo que sucede con los átomos de calcio. Por lo general, cuando un metal reacciona con oxígeno u otro no metal reactivo, la red metálica pierde electrones, de modo que el metal se oxida. En la reacción anterior, el calcio se oxidó. En la reacción siguiente, se oxida el magnesio: Mg(s)+Cl2(g) →Mg2+(s)+2Cl-(s) Del mismo modo un no metal se reduce cuando reacciona con un metal: los átomos del no metal ganan electrones. En los dos últimos ejemplos se redujeron el oxígeno y el cloro. COMBUSTIÓN La combustión es una reacción química en la cual, generlamente se desprende una gran cantidad de calor y luz. En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente) el cual es generalmente oxígeno en forma de O2 gaseoso. En una reacción completa todos los elementos tienen el mayor estado de oxidación. En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas. Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define comk, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente. La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión. .
LA QUIMICA Y LA SUSTITUCION DE SUELOS
Los cultivos sin suelos (hipodrónicos o aeropónicos)son una alternativa imprescendible, que obtimiza los beneficios en el empleo de estructuras que mejoran las condiciones medioambientales, cuyo principal objetivo es eliminar o disminuir los factores limitantes del crecimiento vegetal sustituyendolo por otros soportes de cultivo y aplicando técnicas de fertilización alternativas. Existen variantes más sofisticadas de la aeroponía tradicional como el Schwalbach System (SS) y el Aero-Gro System (AGS), desarrolladas ambas en Australia. La Ciencia de los Sustratos alternativos tiene como base el cultivo de plantas sin utilizar el suelo, de forma que las raíces de las mismas se encuentren suspendidas en un soporte inerte (grava, arena, turba) -lo que se conoce con el nombre de hidroponía-, en la propia disolución nutritiva, lo que exige una recirculación constante de la misma, impidiendo un proceso de anaerobiosis que causaría la muerte inmediata del cultivo-hidroponía pura- o en el interior de una cámara de PVC o cualquier otro material, con las paredes perforadas, por donde se introducen las plantas; en tal caso, las raíces están al aire, crecen en la oscuridad y la disolución nutritiva se destribuye por pulverización a media o baja presión-este sistema recibe el nombre de aeroponía. Enfermedades de las plantas en los cultivos sin suelo: El problema de las enfermedades puede ser diferente o tener distinta extensión en los cultivos sin suelo. Por ejemplo algunos patógenos como Pythium, Phytophthora, cucumber Green Mottle Mosaic Virus y tomapo Mosaic Virusque afectan menos a los cultivos tradicionales pero pueden ser importantes en hidroponía
SISTEMA DE CULTIVOS SIN
SUELOS
•Dependiendo del medio en el que se desarrollan las raíces se pueden clasificar en tres grupos •Cultivos en sustrato: pueden funcionar por inundación periódica del sustrato •Cultivos en agua (hipodropónicos) •Cultivos en aire (aeropónicos): la principal ventaja que aporta es la excelente aireacion que el sistema proporciona a las raíces.
 EJEMPLO DE HIDROPONIA
EJEMPLO DE HIDROPONIALA FERMENTACION
Habrás observado cuando se deja un recipiente con leche sin refrigerar por espacio de uno o dos días, que la composición de ésta cambia, se empieza a formar un sólido (cuajo) y su sabor cambia, se agria, ¿cómo explicarías este fenómeno? Alguna vez haz agregado unas gotas de limón a un vaso con leche, ¿qué sucede? ¿cómo explicarías lo que provoca el jugo de limón?
GUIÓN. Material Sustancias 1 Vaso de precipitados de 1000 mL 1 bureta de 250 mL 1 litro de leche entera 1 mechero bunsen Disolución de Cloruro de calcio al 50 % 1 termómetro de alcohol Agua destilada 2 vasos de precipitados, uno de 250 mL y otro de 50 mL Cloruro de sodio 1 soporte Universal completo cuajo líquido (cuamex) o cuajo de res molido en la licuadora 1 cuchillo Disolución 0.1 M de NaOH 1 m2 de manta Indicador Universal 1 canasta para queso Papel pH 1 cuchara de madera 1 probeta de 100 mL Procedimiento: I. Formación de Queso. 1. Vacía 500 mL de leche en el vaso de precipitados de 1000 mL y calienta a 37 oC durante 5 minutos. 2. Toma 10 mL de la disolución preparada de cloruro de calcio y agrégaselo a la leche, continúa agitando. 3. Agrega de 5 a 7 gotas de cuajo líquido, agita. Suspende el calentamiento 4. Deja reposar por espacio de media hora 5. En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo. 6. Corta la cuajada en trozos aproximadamente de 1 cm2. 7. Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero. 8. Una vez separado el suero del queso, agrégale un poco de cloruro de sodio y mezcla bien. 9. Finalmente pásalo a un recipiente previamente humedecido, espera a que deje de escurrir y estará listo. 10. Toma una porción para realizar el análisis cualitativo de componentes. Preparaciones: • Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada. • Si utilizas cuajo de res lícualo y agrega 25 mL del cuajo molido en 100 mL de agua destilada.

II. Análisis del Suero. Parte A. 1. Introduce un papel pH al suero y anota su valor. ¿qué tipo de sustancia es? 2. Toma 10 mL del suero y vacíalo en un vaso de precipitados de 50 mL, agrégale unas gotas de indicador universal. 3. Coloca una bureta en un soporte universal y llénala de una disolución 0.1 M de NaOH. 4. Procede a titular el suero, agregando gota a gota la disolución valorada de NaOH sobre los 10 mL del suero, conforme agregues la disolución de hidróxido de sodio agita cuidadosamente el vaso con el suero para homogenizarla. 5. En el momento en que la disolución cambie de color a verde, se habrá neutralizado. 6. Anota la cantidad de disolución de hidróxido de sodio que agregaste al vaso 7. Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero. Parte B. -Reconocimiento de glúcidos.
1. Mezcla en un tubo de ensaye 1 mL de solución de Fehling A con 1 mL de Solución de Fehling B. (Reactivo de Fehling) 2. En otro tubo de ensaye pon 1 ml de suero y añade 1 ml de reactivo de Fehling, agita para mezclar y calienta el tubo a baño maría. - Proteínas solubles (Lactalbúmina y lactoglobulina). 1. En un tubo de ensaye agrega 1 mL de hidróxido de sodio al 40% y añade unas 5 gotas de solución de sulfato de cobre 0.01 M y agita. Aparece un color azul. 2. En otro tubo de ensaye pon 1 mL de suero. Vierte sobre de él, el contenido del tubo anterior y agita para que se mezcle. ¿Qué ocurre? - Reconocimiento de la naturaleza Proteica de la Caseína. Recoge con una espátula la porción del queso que separaste (caseína), ponlo en un papel filtro seco, con el mismo papel presiona el sólido hasta que quede bien seco. Reacción Xantoproteica 1. Coloca en un tubo de ensaye una pequeña porción de la caseína lavada y seca, agrégale unas gotas de ácido nítrico y calienta a baño maría por espacio de unos segundos. ¿qué observas? 2. Agrega un mL de hidróxido de amonio, ¿qué observas? Reacción de biuret. 1. Agrega en un tubo de ensaye una porción de caseína y añádela 1 mL de hidróxido `e sodio al 40 % y agita para que se disuelva. 2. Agrega unas gotas de sulfato de cobre 0.01 M. El color violáceo indicará la presencia proteica - Reconocimiento de lípidos. 1. Toma otra porción del sólido y agrégale gotas de éter. Deposítala sobre un trozo de papel filtro limpio. Cuando se evapore el éter aparecerá en el papel una mancha típica de grasa. 2. También se puede vaciar el contenido del tubo en una cápsula de porcelana, colócala en un lugar caliente (al sol) espera a que se evapore el éter, el sólido que queda deberá tener características de las grasas, untuoso al tacto, manchará el papel
OBSERVACIONES: si uno agrga demasido de ña pastilla cuajo, entonces el queso queda como cortado y ya no se puede reparar.
CONCLUSION:ya sea el limon o la pastilla cuajo, el queso cambiara de apariencia y composicion, se agriara y formara solidos, lo que cmprueba la existencia de un aumento de ph.
EL QUESO DESPUES DE SER FILTRADO
EL PAN
PAN
Los alimentos permiten regenerar los tejidos del cuerpo y le suministran energía. Comprenden las sustancias que se han clasificado como glúcidos, grasas, proteínas, minerales y vitaminas. El cuerpo humano está constituido únicamente de los elementos químicos que están contenidos en su alimentación. GUIÓN. Material. 1 Gradilla 1 vidrio de reloj 6 Tubos de ensaye 1 mechero de alcohol Estufa a 90-95oC Pinzas para tubo de ensaye Balanza 3 pipetas Cristalizador Sustancias. Agua destilada Molibdato de amonio al 16% Nitrato de plata 0.1 N Ácido nítrico concentrado Cloruro de bario 1 N Reactivo de Fehlin A y B Nitrato de amonio 1 N Lugol NaOh al 40 % Hidróxido de amonio Sulfato de cobre Parte A. 1. Coloca en un tubo de ensaye un trozo de miga de pan. 2. Con las pinzas calienta en el tubo de ensaye en la llama del mechero, anota tus observaciones. ¿De qué pueden ser las gotas que aparecen en el tubo de en-saye? Parte B. Presencia de Sales en el Pan. Cloruros. 1. Introducir un trozo de pan en un tubo de ensaye 2. Añadir agua destilada que sobre salga aproximadamente un cm. del trozo de pan. 3. Espera de 2 a 3 minutos, agita el tubo de ensaye, y a conti-nuación añade gota a gota nitrato de plata. ¿Qué observas? (precipitado blanco) Fosfatos. 1. Introducir un trozo de miga en otro tubo de ensaye 2. Añade agua destilada suficiente hasta que sobre salga del nivel de la miga. 3. Agitar el tubo `e ensaye y añadir gota a gota una solución de cloruro de bario 1N. ¿Qué observas? (precipitado blanco) o 1. Poner en un tubo de ensaye 1 mL de disolución de molibda-to de amonio al 15%. 2. Añadir 0.5 mL de HNO3 concentrado y 0.5 mL de agua desti-lada, agitar, esta mezcla constituye el reactivo específico del fósforo. 3. Poner en otro tubo de ensaye un trozo de la miga de pan 4. Añadir agua destilada hasta rebasar el nivel del pan (arriba de 2 cm). 5. Añadir 5 gotas de la disolución de nitrato de amonio y poste-riormente 1 mL del reactivo de fósforo preparado anterior-mente. 6. Colocar el tubo a un baño maría (precipitado amarillo) Parte C Análisis de Glúcidos. Azúcares 1. Poner en un tubo de ensaye 1 mL de reactivo de Fehling A y añadir 1 mL de Fehling B 2. Introducir un trozo de miga de pan en el tubo y llevarlo al baño maría. ¿Qué observas? Se observará la reducción del reactivo, debido a la maltosa y glucosa presentes en el pan, formadas por la fermentación del almidón de la harina llevada a cabo por la levadura. Almidón. 1. Pon un trozo de pan en un tubo de ensaye y agrégale 10 mL de agua, caliéntalo a baño maría, cuando esté hirviendo, se verá una especie de engrudo, a contra luz se observará una difusión. 2. En otro tubo prepara el reactivo de Fehling mezclando 2 mL de Fehling con 2 mL de Fehling B. 3. Toma en otro tubo 1 mL del contenido del primer tubo (con el engrudo) y agrégalo al tubo que contiene el reactivo de Fehling, y agrégale de 3 a 4 gotas de lugol, observa qué ocu-rre. Análisis de Lípidos. 1. Tomar un trozo de miga de pan y frotar con ella una hoja de papel blanco: no dejará residuos grasos, con lo que se comprueba la pequeñísima cantidad de estos compuestos en el pan. Análisis de Próti`os 1. Tomar un trozo de miga de pan como un puñado, amasarlo y apretarlo hasta conseguir una bola espesa.
2. Sigue amasándolo debajo de un chorro de agua, poniéndolo debajo un cristalizador cubierto con una malla o gasa, sujeta al recipiente por una liga. 3. Cuando no te quede miga en la mano, se apreciará en la tela o malla una sustancia grisácea, recógela con la espátula y haz con ella dos bolitas e introdúcelas cada una en un tubo de ensaye. 4. En el primer tubo de ensaye añade 1 mL de ácido nítrico y calienta en baño maría. ¿qué observas? 5. Retira el exceso de ácido (vacíalo a un vaso que contenga agua de cal) reteniendo la bolita con la varilla, y echa 1 mL de hidróxido de amonio concentrado. ¿qué observas? 6. En el segundo tubo de ensayo añade 1 mL de NaOH al 40% y 10 gotas de sulfato de cobre 0.1 M- Agita, ¿qué observas?
OBSERVACIONES: en el momento de hacer el filtrado del pan, procura q la malla sea de calidad y con poros muy pequeños
CONCLUSION:sin duda la prescencia de multiples grasas, glucidos(silo e el caso del pan salado)y sales (pan no dulce) es un hecho en el pan.
EN LA IMAGEN , SE OBSERVA EL COLOE DEL PAN, COMPROBANDO LA EXISTENCIA DE GRASAS , GLUCIDOS ETC
COMPOSICION ORGANICA DEL SUELO
La composición orgánica del suelo está constituida por dos componentes, los orgánicos y los inorgánicos. A su vez, la parte orgánica está formada por los residuos de vegetales y animales que se encuentran en diferenpes grados de descomposición, lo que es causado por la presencia de microorganismos. La inorgánica la constituyen el conjunto de minerales que se estudiarán más adelante.
Cuando la mayor parte de la materia orgánica se ha degradado a sus componentes más simples se les nombra HUMUS, el cual es una mezcla de diversas sustancias en las que se integran partículas de diferentes tamaños entre los que se encuentran los coloides. Estos pueden intercambiar iones, ayudan a la formación del suelo y también retienen gran cantidad de agua y de nutrientes. Existen otros microorganismos que se encargan de fijar el nitrógeno del aire atmosférico al suelo, transformándolo en compuestos inorgánicos simples y solubles, por ejemplo, el amoniaco y los nitratos. Estos últimos son absorbidos por las raíces de las plantas para la fabricación de sustancias como las proteínas. 1. Realiza un cuadro comparativo an el que indiques las características representativas de las sustancias orgánicas y de las sustancias inorgánicas. Características. Construye una tabla con las características de cada tipo. Sustancias Orgánicas Sustancias Inorgánicas Se incendia por contener carbono, proviene de material animal,plantas ets XtContienen un ph, para saber el grado de acides, sales binarioas y minerales

DETERMINACIÓN DEL PORCENTAJE DE MATERIA ORGÁNICA. Objetivos. Observar y describir las características de los componentes de la fase sólida del suelo. Calcular el porcentaje de materia orgánica de las cuatro muestras de suelo. Material Sustancias Cápsula de porcelana Balanza 10 g de muestra de suelo Mechero bunsen Pinzas para crisol (4 muestras diferentes de suelo) Soporte universal con anillo y rejilla de asbesto Procedimiento. 1. Pesar 10 g de suelo seco en una cápsula de porcelana. 2. Colocar la cápsula de porcelana en la rejilla del soporte universal, enciende el mechero, y calienta hasta la calcinación (de 15 a 20 minutos). S
Si la muestra de suelo posee un alto contenido de hojarasca, el tiempo se prolongará lo suficiente hasta su total calcinación. 3. Dejar enfriar la mezcla y posteriormente pésala nuevamente, anotando la variación de la masa. 4.XtCalcular el porcentaje de materia orgánica.
OBSERVACIONES:la materia organica es en porcentaje menor q la materia inorganica, la materia organica se puede incendiar facilmente
CONCLUSION:el humus esta integrado por componentes como plamta, y materiales formasdos con carbono
Cuando la mayor parte de la materia orgánica se ha degradado a sus componentes más simples se les nombra HUMUS, el cual es una mezcla de diversas sustancias en las que se integran partículas de diferentes tamaños entre los que se encuentran los coloides. Estos pueden intercambiar iones, ayudan a la formación del suelo y también retienen gran cantidad de agua y de nutrientes. Existen otros microorganismos que se encargan de fijar el nitrógeno del aire atmosférico al suelo, transformándolo en compuestos inorgánicos simples y solubles, por ejemplo, el amoniaco y los nitratos. Estos últimos son absorbidos por las raíces de las plantas para la fabricación de sustancias como las proteínas. 1. Realiza un cuadro comparativo an el que indiques las características representativas de las sustancias orgánicas y de las sustancias inorgánicas. Características. Construye una tabla con las características de cada tipo. Sustancias Orgánicas Sustancias Inorgánicas Se incendia por contener carbono, proviene de material animal,plantas ets XtContienen un ph, para saber el grado de acides, sales binarioas y minerales

DETERMINACIÓN DEL PORCENTAJE DE MATERIA ORGÁNICA. Objetivos. Observar y describir las características de los componentes de la fase sólida del suelo. Calcular el porcentaje de materia orgánica de las cuatro muestras de suelo. Material Sustancias Cápsula de porcelana Balanza 10 g de muestra de suelo Mechero bunsen Pinzas para crisol (4 muestras diferentes de suelo) Soporte universal con anillo y rejilla de asbesto Procedimiento. 1. Pesar 10 g de suelo seco en una cápsula de porcelana. 2. Colocar la cápsula de porcelana en la rejilla del soporte universal, enciende el mechero, y calienta hasta la calcinación (de 15 a 20 minutos). S
Si la muestra de suelo posee un alto contenido de hojarasca, el tiempo se prolongará lo suficiente hasta su total calcinación. 3. Dejar enfriar la mezcla y posteriormente pésala nuevamente, anotando la variación de la masa. 4.XtCalcular el porcentaje de materia orgánica.
OBSERVACIONES:la materia organica es en porcentaje menor q la materia inorganica, la materia organica se puede incendiar facilmente
CONCLUSION:el humus esta integrado por componentes como plamta, y materiales formasdos con carbono
COMPONENTES INORGANICOS DEL SUELO
Objetivos: Señalará cuales son los cationes y aniones más comunes que están presentes en la parte inorgánica del suelo. Reconocerá que los compuestos inorgánicos se clasifican óxidos, hidróxidos, ácidos y sales. Aplicará el concepto ion a la composición de sales. Clasificará a las sales en carbonatos, sulfatos, nitratos, fosfatos, cloruros y silicatos.
Procedimiento:
1. Extracción acuosa de la muestra de suelo.
Pesa 10 g de suelo previamente seca al airey tamízalo a través de una malla de 2 mm. Introduce la muestra en un matraz y agrega 50 mL de agua destilada. Tapa el matraz y agita el contenido de 3 a 5 minutos. Filtra el extracto, y en caso de que éste sea turbio, repite la operación utilizando el mismo filtro. Al concluir la filtración tapa el matraz.
IDENTIFICACIÓN DE ANIONES 2. Identificación de cloruros (Cl-1). Reacción Testigo: en un tubo de ensaye coloca 2 mL de agua destilada y agrega algunos cristales de algún cloruro (cloruro de sodio, de potasio, de calcio, etc.). Agita hasta disolver y agrega unas gotas de solución de AgNO3 0.1N (nitrata de plata al 0.1 N). Observarás la formación de un precipitado blanco, que se ennegrecerá al pasar unos minutos. Esta reacción química es característica de este ión. Muestra de suelo: en un tubo de ensayo coloca 2 mL del filtrado. Agrega unas gotas de ácido nítrico diluido hasta eliminar la efervescencia. Agrega unas gotas de solución de AgNO3 0.1N. Compara con tu muestra testigo. 3. Identificación de Sulfatos (SO4-2). Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfato (sulfato de sodio o de potasio) Agrega unas gotas de cloruro de bario al 10%. Observarás una turbidez, que se ennegrecerá al pasar unos minutos. Muestra del suelo: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona unas gotas de cloruro de bario al 10 %. Compara con tu muestra testigo. 4. Identificación de Carbonatos (CO3-2). Reacción testigo: en un vidrio de reloj, coloca un poco de carbonato de calcio y adiciona unas gotas de ácido clorhídrico diluido. Observarás efervescencia por la presencia de carbonatos. Muestra de suelo: en un vidrio de reloj, coloca un poco de muestra de suelo seco. Adiciona unas gotas de ácido clorhídrico diluido. Compara con la muestra testigo. 5. Identificación de sulfuros (S-2) Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfuro. Adiciona unas gotas de cloruro de bario al 10% y un exceso de ácido clorhídrico. Observarás que se forma una turbidez, que con el paso del tiempo se ennegrecerá. Reacción muestra: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona tres gotas de cloruro de bario al 10 % y un exceso de ácido clorhídrico. Compara con tu muestra testigo. 6. Identificación de nitratos (NO3-1). Reacción testigo: un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún nitrato (de sodio por ejemplo), y agita para disolver. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado.
 ALGUNOS MINERALES
ALGUNOS MINERALES
PRECAUCIÓN: ESTA REACCIÓN ES FUERTEMENTE EXOTÉRMICA. Evita agitación innecesaria. Deja reposar unos minutos y observa la formación de un anillo café. Reacción muestra: coloca 2 mL de filtrado del suelo en un tubo de ensayo. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado. Sigue las indicaciones de la muestra testigo y compárala.
IDENTIFICACIÓN DE CATIONES 7. Identificación de Calcio (Ca+2). Introduce un alambre de nicromel en el extracto de suelo y acércalo a la flaia del mechero bunsen. Si observas una flama de color naranja, indicará la presencia de este catión. 8. Identificación de Sodio (Na+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Disuelve la muestra con 5 mL de solución de ácido clorhídrico (1:1). Introduce el alambre de nicromel y humedécelo en la solución, llévalo a la flama del mechero, si espa se colorea de amarillo indicará la presencia de iones sodio. 9. Identificación de Potasio (K+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Agrega 20 mL de acetato de sodio 1N y agita 5 minutos. Filtra la suspensión, toma un alambre de nicromel, humedécelo en esta suspensión y llévalo a la flama del mechero bunsen. Si hay presencia de iones potasio se observa
una flama de color violeta.
 CATIONES DEL SUELO
CATIONES DEL SUELO
IDENTIFICACIÓN DE ANIONES 2. Identificación de cloruros (Cl-1). Reacción Testigo: en un tubo de ensaye coloca 2 mL de agua destilada y agrega algunos cristales de algún cloruro (cloruro de sodio, de potasio, de calcio, etc.). Agita hasta disolver y agrega unas gotas de solución de AgNO3 0.1N (nitrata de plata al 0.1 N). Observarás la formación de un precipitado blanco, que se ennegrecerá al pasar unos minutos. Esta reacción química es característica de este ión. Muestra de suelo: en un tubo de ensayo coloca 2 mL del filtrado. Agrega unas gotas de ácido nítrico diluido hasta eliminar la efervescencia. Agrega unas gotas de solución de AgNO3 0.1N. Compara con tu muestra testigo. 3. Identificación de Sulfatos (SO4-2). Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfato (sulfato de sodio o de potasio) Agrega unas gotas de cloruro de bario al 10%. Observarás una turbidez, que se ennegrecerá al pasar unos minutos. Muestra del suelo: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona unas gotas de cloruro de bario al 10 %. Compara con tu muestra testigo. 4. Identificación de Carbonatos (CO3-2). Reacción testigo: en un vidrio de reloj, coloca un poco de carbonato de calcio y adiciona unas gotas de ácido clorhídrico diluido. Observarás efervescencia por la presencia de carbonatos. Muestra de suelo: en un vidrio de reloj, coloca un poco de muestra de suelo seco. Adiciona unas gotas de ácido clorhídrico diluido. Compara con la muestra testigo. 5. Identificación de sulfuros (S-2) Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfuro. Adiciona unas gotas de cloruro de bario al 10% y un exceso de ácido clorhídrico. Observarás que se forma una turbidez, que con el paso del tiempo se ennegrecerá. Reacción muestra: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona tres gotas de cloruro de bario al 10 % y un exceso de ácido clorhídrico. Compara con tu muestra testigo. 6. Identificación de nitratos (NO3-1). Reacción testigo: un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún nitrato (de sodio por ejemplo), y agita para disolver. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado.
 ALGUNOS MINERALES
ALGUNOS MINERALESPRECAUCIÓN: ESTA REACCIÓN ES FUERTEMENTE EXOTÉRMICA. Evita agitación innecesaria. Deja reposar unos minutos y observa la formación de un anillo café. Reacción muestra: coloca 2 mL de filtrado del suelo en un tubo de ensayo. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado. Sigue las indicaciones de la muestra testigo y compárala.
IDENTIFICACIÓN DE CATIONES 7. Identificación de Calcio (Ca+2). Introduce un alambre de nicromel en el extracto de suelo y acércalo a la flaia del mechero bunsen. Si observas una flama de color naranja, indicará la presencia de este catión. 8. Identificación de Sodio (Na+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Disuelve la muestra con 5 mL de solución de ácido clorhídrico (1:1). Introduce el alambre de nicromel y humedécelo en la solución, llévalo a la flama del mechero, si espa se colorea de amarillo indicará la presencia de iones sodio. 9. Identificación de Potasio (K+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Agrega 20 mL de acetato de sodio 1N y agita 5 minutos. Filtra la suspensión, toma un alambre de nicromel, humedécelo en esta suspensión y llévalo a la flama del mechero bunsen. Si hay presencia de iones potasio se observa
una flama de color violeta.
 CATIONES DEL SUELO
CATIONES DEL SUELOMUESTRAS DE SUELOS
PROPIEDADES FÍSICAS
Propiedad ¿Cómo medirla?
Densidad
1. Para medir la masa de una muestra de tierra, se coloca ésta en una balanza (utiliza un vidrio de reloj o cápsula de porcelana) para colocarla en el platillo de la balanza.
2. Para determinar el volumen de la muestra de suelo, una vez medida su masa en la balanza, se hace por medio de desplazamiento de agua (considerando que la tierra es un sólido insoluble en ésta.
3. Volumen por desplazamiento de agua. En una probeta agrega 20 o 30 mL de agua (dependiendo de la cantidad de tierra que hayas medido su masa) y posteriormente agrega la tierra, el aumento en el nivel del agua corresponde al volumen de la tierra.
4. Volumen agua + Volumen de tierra = V2
Entonces Volumen de tierra = V2 - Volumen de agua
Así
% Humedad Indica la cantidad de agua que existe en el suelo (tipo de tierra) expresada en porcenta-je.
1. Mide la masa de una muestra de suelo en una balanza; en una cápsula o crisol de por-celana. Recuerda medir previamente la MASA DE LA CÁPSULA O CRISOL, para restarle posteriormente su valor. (masa inicial)
2. Como se requiere conocer la cantidad de agua que contiene el suelo, necesitamos eliminar ésta de la muestra, por ello, debemos calentar hasta lograrlo, para tener un calentamiento homogéneo utilizamos una estufa o mufla, el tiempo necesario depen-diendo del tamaño de muestra.
3. Una vez eliminada el agua de la mezcla, procedemos a medir la masa nuevamente (masa final).
4. A ambos valores de masa hay que restar el valor de la masa de la cápsula o crisol.
Entonces:
Masa de agua = masa inicial - masa final
% Humedad será:
Masa inicial - 100%
Masa agua - X % X% = % Humedad
Cantidad de Aire en el Suelo
% Aire
(Porosidad) La cantidad de aire que contiene un tipo de suelo, depende del tamaño de partículas que posea la mezcla. Por el tamaño de éstas partículas se tiene mayor o menor porosidad, y por lo tanto tendremos mayor o menor cantidad de aire entre éstas.
Para medirlo tenemos que:
1. Medir en una probeta de 50 o 100 mL completamente seca, el volumen de una muestra de suelo.
2. Medir en una probeta de 50 o 100 mL completamente seca, el volumen de una muestra de suelo.
3. En otra probeta de 50 o 100 mL agregar 30 mL de agua.
4. Vaciar la tierra (una vez que hayas medido su volumen) a la probeta que contiene el agua, observaras que el nivel del líquido cambia y salen algunas burbujas de aire.
Así, tenemos volumen de tierra seca (V1), volumen de agua (V2) y volumen de agua con tierra (V3), entonces:
Si V3 - V2 = Volumen de aire
Volumen de tierra seca - 100%
Volumen de aire - Y% Y% = % Aire
Propiedad ¿Cómo medirla?
Solubilidad Esta propiedad no la determinaremos por cada uno de los componenpes de la mezcla de suelo, nos abocaremos a considerar en cada muestra que hay materia que es soluble en agua y otra que no lo es (sin considerar cuantas sustancias lo son y cual es su valor de solubilidad)
Por lo tanto consideraremos que tendremos un porcentaje en masa de materia soluble y de materia insoluble, entonces determinaremos:
1. Medir la masa de una muestra de suelo (M1), en una cápsula de porcelana (a la cual previamente tendrás que determinar su masa)
2. Agregar agua y agitar la mezcla para ayudar a disolver a las sustancias solubles.
3. Filtrar la mezcla y recoger el filtrado en la cápsula de porcelana limpia.
4. Evaporar el agua del filtrado hasta la cristalización de alguna sustancia.
5. Dejar enfriar y medir nuevamente la masa del contenido de la cápsula (M2)
Entonces:
Cantidad de sustancias solubles = M2
Cantidad de sustancias Insolubles = M1 - M2
M1 - 100%
M2 - Z% Z% = % de materia soluble en la muestra
Observaciones:
En toda actividad tenemos que fijarnos lo que ocurre en cada uno de los procedimientos que seguimos e irlos anotando, para tener registrados todos aquellos cambios o alteraciones de lo que estamos haciendo. Es reco-mendable registrar todas aquellas observaciones que nos permitan argumentar si lo realizado esta bien hecho o tendríamos que hacer modificaciones a nuestro procedimiento.
Análisis.
En todas las activida`es deberás hacer un análisis que consiste en una revisión, tanto de las observaciones reali-zadas, así como, de los datos y/o resultados que haz obtenido para cotejar, comparar y examinar el comporta-miento de lo que se pretende en la experimentación. Este análisis permitirá contar con elementos que sirvan para justificar y aprobar la (s) hipótesis planteadas.
Por ello, en esta actividad experimental tendrás que analizar los resultados de las propieda`es físicas de cada una de las muestras de suelo, compararlas con el resto de estas muestras y considerar por ello, las característi-cas que tiene cada tipo de suelo de las muestras analizadas.
domingo, 25 de marzo de 2012
ETERES
ALCOHOLES
El grupo funcional de un alcohol es el grupo hidroxilo, -OH, enlazado a un átomo de carbono con hibridación sp3. Dos orbitales de híbridos sp3 del oxígeno forman enlaces sigma con los átomos de carbono e hidrógeno. Los otros dos orbitales híbridos sp3 del oxígeno contienen cada uno un par de electrones no compartidos. El metanol, CH3OH es el alcohol más simple, y su ángulo de enlace H-C-O es de 108.9º, muy cercano al ángulo tetraédrico de 109.5º
ÉTERES
El grupo funcional de un éter es un átomo de oxígeno enlazado con dos átomos de carbono. En el éter dimetílico, dos orbitales híbridos sp3 del oxígeno forman enlaces sigma con átomos de carbono.
TIOLES
El grupo funcional de un tiol es el grupo sulfhidrilo, -SH. El tiol más simple es el metanotiol, CH3SH. Su ángulo de enlace C-S-H del metanotiol es 100.3º.
-ESTRUCTURA Y CLASIFICACIÓN
Las aminas se dividen, además, en aminas alifáticas y aromáticas. En una amina alifática, todos los carbonos enlazados directamente con el nitrógeno se derivan de grupos alquilo; en una amina aromática, uno o más de los grupos enlazados directamente con el nitrógeno son grupos arilo.
Una amina en la cual el átomo de nitrógeno forma parte del anillo se clasifica como amina heterocíclica. Cuando el nitrógeno forma parte del anillo aromático, la amina se clasifica como amina aromática heterocíclica.
-ESTRUCTURA Y ENLACE
El grupo funcional de un aldehído es un grupo carbonilo unido a un átomo de hidrógeno. En el metanal, el aldehído más simple, el grupo carbonilo está unido a dos átomos de hidrógeno. En otros aldehídos se encuentra enlazado con un átomo de hidrógeno y un átomo de carbono. El grupo funcional de una cetona es un grupo carbonilo enlazado con dos átomos de carbono.
NOMENCLATURA DE LA IUPAC
El sistema de nomenclatura de la IUPAC para aldehídos y cetonas sigue el patrón familiar de elegir como alcano principal la cadena más larga de átomos de carbono que contenga el grupo funcional. El grupo aldehído se indica modificando el sufijo –o del alcano principal por –al; por ejemplo, metanal. Puesto Que el grupo carbonilo del aldehído sólo puede aparecer al final de una cadena principal y la numeración debe iniciarse tomando este carbono como 1, su posición es clara y no es necesario usar números para indicarla.
TRIGLICÉRIDOS
Las grasas animales y los aceites vegetales, que son los lípidos más abundantes en la naturaleza, son triésteres de glicerol y ácidos carboxílicos de cadena larga. Las grasas y los aceites también se denominan triglicéridos o triacilgliceroles. La hidrólisis de un triglicérido con base acuosa seguida de una acidificación, forma glicerol y tres ácidos grasos.
ALCOHOLES, ACETONAS ETC
Etanol
El compuesto químico etanol, conocido como alcohol etílico, es un alcohol que se presenpa en condiciones normales de presión y temperatura como un líquido incoloro e inflamable con un punto de ebullición de 78 °C.
Mezclable con agua en cualquier proporción; a la concentración de 95% en peso se forma una mezcla azeotrópica.
Su fórmula química es CH3-CH2-OH (C2H6O), principal producto de las bebidas alcohólicas como el vino (alrededor de un 13%), la cerveza (5%) o licores (hasta un 50%).
El etanol a temperatura y presión ambientes es un líquido incoloro y volátil que está presente en diversas bebidas fermentadas. Desde la antigüedad se obtenía el etanol por fermentación anaeróbica de una disolución con contenido en azúcares con levadura y posterior destilación.
Dependiendo del género de bebida alcohólica que lo contenga, el etanol aparece acompañado de distintas sustancias químicos que la dotan de color, sabor, y olor, entre otras características.
Para obtener etanol libre de agua se aplica la destilación azeotrópica en una mezcla con benceno o ciclohexano. De estas mezclas se destila a temperaturas más bajas el azeótropo, formado por el disolvente auxiliar con el agua, mientras que el etanol se queda retenido. Otro método de purificación muy utilizado actualmente es la absorción física mediante tamices molecqlares. A escala de laboratorio también se pueden utilizar desecantes como el magnesio, que reacciona con el agua formando hidrógeno y óxido de magnesio.
Aplicaciones
Además de usarse con fines culinarios (bebida alcohólica), el etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Enercía de EUA dicen que el uso en automóviles reduce la producción de gases de invernadero en un 85%.[cita requerida] En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
Acetona
La acetona o propanona es un compuesto químico de fórmula química CH3(CO)CH3 del grupo de las cetonas que se encuentra naturalmente en el medio ambiente. A temperatura ambiente se presenta como un líquido incoloro de olor característico. Se evapora fácilmente, es inflamable y es soluble en agua. La acetona sintetizada se usa en la fabricación de plásticos, fibras, medicamentos y otros productos químicos, así como disolvente de otras sustancias químicas.
•
La nomenclatura de la acetona según la IUPAC es propanona. Y la nomenclatura común es dimetil cetona. Son erróneas por redundantes las denominaciones 2-propanona y propan-2-ona porque el grupo funcional cetona sólo puede encontrarse en el segundo carbono de la molécula.
Sacarina
.
La sacarina es uno de los edulcorantes más antiguos. Fue descubierto en 1879 por Ira Remsen y Constantine Fahlberg, de la Universidad Johns Hopkins. Químicamente es una imida o-sulfobenzoica. En la industria alimentaria se conoce con las siglas E954.
•
La sacarina fue sintetizada en 1878 a partir de experimentos con derivados de la hulla, y se utiliza como edulcorante desde principios del siglo XX. Actualmente se obtiene mediante síntesis química del tolueno o de otros derivados del petróleo. Debido a la gran potencia edulcorante de la sacarina, se suele utilizar en disolución acuosa. La forma más utilizada es la sal sódica, ya que en la forma ácida es muy poco soluble en agua. Tiene un regusto amargo, sobre todo cuando se utiliza a concentraciones altas, pero este regusto puede enmascararse con otras sustancias. Es un edulcorante resistente al calentamiento y a medios
Se usa como edulcorante no calórico, y en medicina cuando está contraindicada la toma de azúcar. Se emplea en la elaboración de bebidas refrescantes, en yogures edulcorados y en productos dietéticos para diabéticos.
Etilenglicol
El etilenglicol (sinónimos: 1,2-Etanodiol, glicol de etileno, glicol) es un compuesto químico que pertenece al grupo de los dioles. El etilenglicol es un líquido transparente, incoloro, ligeramente espeso como el almíbar y leve sabor dulce, son por estas características organolépticas que se suele utilizar distintos colorantes para reconocerlo y asi disminuir las intoxicaciones por accidentes. A temperatura ambiente es poco volátil, pero puede existir en el aire an forma de vapor, el etilenglicol es inodoro pero tiene un sabor dulce. Se fabrica a partir de la hidratación del óxido de etileno (epóxido cancerígeno).
Se utiliza como anticongelante en los circuitos de refrigeración de motores de combustión interna, como difusor del calor, para fabricar compuestos de poliéster, y como disolventes en la industria de la pintura y el plástico. El etilenglicol es también un ingrediente en líquidos para revelar fotografías, fluidos para frenos hidráulicos y en tinturas usadas en almohadillas para estampar, bolígrafos, y talleres de imprenta.
GRUPOS FUNCIONALES
GRUPOS FUNCIONALES
El carbono se combina con otros átomos (p. ej., C, H, N, O, S y halógenos) para formar unidades estructurales llamadas grupos funcionales. Estos grupos son importantes por tres motivos. Primero, son las unidades por las cuales se dividen los compuestos orgánicos en clases. Segundo, son los sitios donde se llevan a cabo las reacciones químicas; un grupo funcional específico, sin importar el compuesto del cual forma parte, experimentará el mismo tipo de reacciones químicas. Tercero, estos grupos sirven de base para nombrar los compuestos orgánicos.
a) Alcoholes
El grupo funcional de un alcohol es un grupo –OH (hidroxilo) enlazado con un átomo de carbono tetraédrico (con hibridación sp3).
Es posible escribir la fórmula de este alcohol de manera más abreviada usando lo que se denomina fórmula estructural condensada. En este tipo de fórmula, CH3 representa un carbono con tres hidrógenos unidos a él.
b) Aldehídos y cetonas
Los aldehídos y las cetonas contienen un grupo C=O (carbonilo). El grupo funcional de un aldehído es un grupo carbonilo que está unido a través de su carbono con dos hidrógenos en el caso del formaldehido, CH2O, el cual es el aldehído más simple, y a otro carbono y un hidrógeno en todos los demás aldehídos. El grupo funcional de una cetona es un grupo carbonilo enlazado con dos átomos de carbono.
d) Aminas
El grupo funcional de una amina es el grupo amino, un átomo de nitrógeno con hibridación sp3 enlazado con uno, dos o tres grupos de carbono. Una amina primaria contiene un grupo de carbono enlazado con el nitrógeno.
ESTRUCTURA DE LOS ALCANOS
El metano, CH4, y el etano, C2H6, son los dos primeros miembros de la familia de los alcanos. La forma del metano es tetraédrica, y todos los ángulos del enlace H-C-H son de 109.5º. Además, cada átomo de carbono del etano es tetraédrico, y todos los ángulos de enlace son aproximadamente de 109.5º.
En las fórmulas moleculares CH4, C2H6 y C3H8, sólo es posible que los átomos estén ordenados de una manera. Sin embargo, en ha fórmula molecular C4H10, los átomos pueden estar ordenados de dos maneras distintas: en una de ellas, llamada butano, los cuatro carbonos están unidos en una cadena; en la otra, llamada 2-metilpropano, tres carbonos están unidos en una cadena y el cuarto constituye una ramificación de la misma. El butano y el 2-metilpropano son isómeros estructurales; son compuestos distintos y tienen propiedades químicas y físicas diferentes.
El hidrocarburo que contiene átomos de carbono unidos de forma de anillo se denomina hidrocarburo cíclico. Cuando todos los carbonos del anillo están saturados, el hidrocarburo se llama cicloalcano. En la naturaleza se encuentran cicloalcanos con anillos desde 3 hasta más de 30 miembros y en teoría no hay límite para el tamaño del anillo. En la naturaleza abundan los anillos de cinco miembros (ciclopentano) y de seis miembros (ciclohexano), y han merecido atención especial.
Aunque las fórmulas estructurales son útiles para indicar el orden de unión de los átomos, generalmente no muestran las formas tridimensionales. A medida que los químicos intentan comprender mejor las relaciones entre la estructura y las propiedades físicas y químicas de las moléculas, es cada vez más importante saber más sobre las formas tridimensionales de las mismas.
a) Alcanos
Los alcanos de dos o más carbonos pueden ordenarse en diversos arreglos atómicos tridimensionales, haciendo girar uno o varios enlaces carbono-carbono. Cualquier arreglo tridimensional de átomos que se deba a la rotación en torno a un enlace simple se llama conformación. En la conformación escalonada del etano los tres enlaces C-H de un carbono se encuentran tan lejos como es posible de los tres enlaces C-H del carbono adyacente. Una manera abreviada de representar esta conformación del etano se llama proyección de Newman.
b) Cicloalcanos
-Ciclopentano. El ciclopentano puede dibujarse con conformación plana, con todos los ángulos de enlace C-C-C iguales a 108º. Este ángulo difiere muy poco del ángulo tetraédrico de 109.5º, y en consecuencia, hay poca tensión angular en la conformación plana del ciclopentano. Sin embargo, hay 10 enlaces C-H totalmente eclipsados, lo cual crea una tensión esférica aproximadamente igual a 10kcal/mol (42kJ/mol). Para aliviar, cuando menos, parte de esta tensión, los átomos del anillo giran en la conformación de “sobre”.
-Ciclohexano. El ciclohexano adopta diversas conformaciones plegadas, la más estable de ellas es la conformación de silla. En este tipo de conformación, todos los ángulos de enlace C-C-C son de 109º (lo cual minimiza la tensión angular), y los hidrógenos que están unidos a los carbonos adyacentes se encuentran ascalonados uno con respecto al otro (minimizando la tensión esférica). Por l¡o tanto, hay muy poca tensión intramolecular en la conformación de silla del ciclohexano.
NOMENCLATURA
El carbono se combina con otros átomos (p. ej., C, H, N, O, S y halógenos) para formar unidades estructurales llamadas grupos funcionales. Estos grupos son importantes por tres motivos. Primero, son las unidades por las cuales se dividen los compuestos orgánicos en clases. Segundo, son los sitios donde se llevan a cabo las reacciones químicas; un grupo funcional específico, sin importar el compuesto del cual forma parte, experimentará el mismo tipo de reacciones químicas. Tercero, estos grupos sirven de base para nombrar los compuestos orgánicos.
a) Alcoholes
El grupo funcional de un alcohol es un grupo –OH (hidroxilo) enlazado con un átomo de carbono tetraédrico (con hibridación sp3).
Es posible escribir la fórmula de este alcohol de manera más abreviada usando lo que se denomina fórmula estructural condensada. En este tipo de fórmula, CH3 representa un carbono con tres hidrógenos unidos a él.
b) Aldehídos y cetonas
Los aldehídos y las cetonas contienen un grupo C=O (carbonilo). El grupo funcional de un aldehído es un grupo carbonilo que está unido a través de su carbono con dos hidrógenos en el caso del formaldehido, CH2O, el cual es el aldehído más simple, y a otro carbono y un hidrógeno en todos los demás aldehídos. El grupo funcional de una cetona es un grupo carbonilo enlazado con dos átomos de carbono.
d) Aminas
El grupo funcional de una amina es el grupo amino, un átomo de nitrógeno con hibridación sp3 enlazado con uno, dos o tres grupos de carbono. Una amina primaria contiene un grupo de carbono enlazado con el nitrógeno.
ESTRUCTURA DE LOS ALCANOS
El metano, CH4, y el etano, C2H6, son los dos primeros miembros de la familia de los alcanos. La forma del metano es tetraédrica, y todos los ángulos del enlace H-C-H son de 109.5º. Además, cada átomo de carbono del etano es tetraédrico, y todos los ángulos de enlace son aproximadamente de 109.5º.
ISOMETRÍA ESTRUCTURAL EN LOS ALCANOS
En las fórmulas moleculares CH4, C2H6 y C3H8, sólo es posible que los átomos estén ordenados de una manera. Sin embargo, en ha fórmula molecular C4H10, los átomos pueden estar ordenados de dos maneras distintas: en una de ellas, llamada butano, los cuatro carbonos están unidos en una cadena; en la otra, llamada 2-metilpropano, tres carbonos están unidos en una cadena y el cuarto constituye una ramificación de la misma. El butano y el 2-metilpropano son isómeros estructurales; son compuestos distintos y tienen propiedades químicas y físicas diferentes.
CICLOALCANOS
El hidrocarburo que contiene átomos de carbono unidos de forma de anillo se denomina hidrocarburo cíclico. Cuando todos los carbonos del anillo están saturados, el hidrocarburo se llama cicloalcano. En la naturaleza se encuentran cicloalcanos con anillos desde 3 hasta más de 30 miembros y en teoría no hay límite para el tamaño del anillo. En la naturaleza abundan los anillos de cinco miembros (ciclopentano) y de seis miembros (ciclohexano), y han merecido atención especial.
CONFORMACIONES DE LOS ALCANOS Y CICLOALCANOS
Aunque las fórmulas estructurales son útiles para indicar el orden de unión de los átomos, generalmente no muestran las formas tridimensionales. A medida que los químicos intentan comprender mejor las relaciones entre la estructura y las propiedades físicas y químicas de las moléculas, es cada vez más importante saber más sobre las formas tridimensionales de las mismas.
a) Alcanos
Los alcanos de dos o más carbonos pueden ordenarse en diversos arreglos atómicos tridimensionales, haciendo girar uno o varios enlaces carbono-carbono. Cualquier arreglo tridimensional de átomos que se deba a la rotación en torno a un enlace simple se llama conformación. En la conformación escalonada del etano los tres enlaces C-H de un carbono se encuentran tan lejos como es posible de los tres enlaces C-H del carbono adyacente. Una manera abreviada de representar esta conformación del etano se llama proyección de Newman.
b) Cicloalcanos
-Ciclopentano. El ciclopentano puede dibujarse con conformación plana, con todos los ángulos de enlace C-C-C iguales a 108º. Este ángulo difiere muy poco del ángulo tetraédrico de 109.5º, y en consecuencia, hay poca tensión angular en la conformación plana del ciclopentano. Sin embargo, hay 10 enlaces C-H totalmente eclipsados, lo cual crea una tensión esférica aproximadamente igual a 10kcal/mol (42kJ/mol). Para aliviar, cuando menos, parte de esta tensión, los átomos del anillo giran en la conformación de “sobre”.
-Ciclohexano. El ciclohexano adopta diversas conformaciones plegadas, la más estable de ellas es la conformación de silla. En este tipo de conformación, todos los ángulos de enlace C-C-C son de 109º (lo cual minimiza la tensión angular), y los hidrógenos que están unidos a los carbonos adyacentes se encuentran ascalonados uno con respecto al otro (minimizando la tensión esférica). Por l¡o tanto, hay muy poca tensión intramolecular en la conformación de silla del ciclohexano.
NOMENCLATURA
El sistema utilizado para nombrar a los compuestos orgánicos es el
conocido como IUPAC, esta permite nombrar de una manera sencilla
cualquier compuesto orgánico a partir de su formula desarrollada,
o viceversa.
El nombre sistemático esta formado por un prefijo, que indica el número
de átomos de carbono que contiene la molécula, y un sufijo que indica la
clase de compuesto orgánico de que se trata, algunos ejemplos de
prefijos:
No de atomos de carbono: Prefijo:
1 Met
2 Et
3 Prop
4 But
5 Pent
6 Hex
7 Hept
8 Oct
9 Non
10 Dec
Hidrocarburos:
Son aquellos compuestos orgánicos que contienen únicamente C e H en su molécula; existen 2 grupos de hidrocarburos:
- Alifáticos:
En este grupo se encuentran los alcanos, alquenos, alquinos y cicloalcanos.
Alcanos.-
Responden a la fórmula general CnH2n+2. Son hidrocarburos acíclicos
(no tienen ciclos en su cadena) saturados (tienen el máximo número de
hidrógenos posible).
Alcanos de cadena lineal -. Se nombran utilizando uno de los prefijos seguido del sufijo -ano.
Ejemplos:
- CH4 metano
- CH3 - CH3 propano
- CH3 - (CH2)4 - CH3 hexano
Alcanos de cadena ramificada -. Para nombrar estos compuestos hay que
seguir los siguientes pasos:
- Buscar la cadena hidrocarbonada más larga. Esta será la cadena "principal". Si hay más de una cadena con la misma longitud se elige como principal aquella que tiene mayor número de cadenas laterales.
- Se numeran los átomos de carbono de la cadena principal comenzando por el extremo más próximo a la ramificación, de tal forma que los carbonos con ramificaciones tengan el número más bajo posible.
- Se nombran las cadenas laterales indicando su posición en la cadena principal con un número que precede al nombre de la cadena lateral; éste se obtiene sustituyendo el prefijo -ano por -il. Si hay dos o más cadenas iguales se utilizan los prefijos di-, tri-, tetra. Tanto los números como estos prefijos se separan del nombre mediante guiones.
- Por último se nombra la cadena principal.
Alquenos y alquinos.
Son los hidrocarburos insaturados que tienen doble enlace carbono -
carbono (alquenos) o triple enlace carbono - carbono (alquinos).
Responden a las fórmulas generales:
- (CnH2n) Alquenos
- (CnH2n -2) Alquinos
Nomenclatura:
Las reglas de la IUPAC para nombrar alquenos y alquinos son semejantes a
las de los alcanos, pero se deben adicionar algunas reglas para
nombrar y localizar los enlaces múltiples:
- Para designar un doble enlace carbono-carbono, se utiliza la terminación -eno. Cuando existen más de un doble enlace, la terminación cambia a -dieno, -trieno y así sucesivamente.
- Para designar un triple enlace se utiliza la terminación -ino (-diino para dos triplesenlaces y así sucesivamente). Los compuestos que tienen un doble y un triple enlace se llaman -eninos.
- Se selecciona la cadena más larga, que incluya ambos carbonos del doble enlace si hay ramificaciones se toma como cadena principal la cadena más larga de las que contienen el doble enlace.
- Numerar la cadena a partir del extremo más cercano al enlace múltiple, de forma que los átomos de carbono de dicho enlace, tengan los números más pequeños posibles. Si el enlace múltiple es equidistante a ambos extremos de la cadena la numeración. Empieza a partir del extremo más cercano a la primera
- Indicar la posición del enlace múltiple mediante el número del primer carbono de dicho enlace.
- Si se encuentran presentes más de un enlace múltiple, numerar a partir del extremo más cercano al primer enlace múltiple. Si un doble y un triple enlace se encuentran equidistantes a los extremos de la cadena, el doble enlace recibirá el número más pequeño.
Ejemplos:
- CH2 = CH2 eteno (etileno)
- CH2 = CH - CH3 propeno (propileno)
- CH = CH etino (acetileno)
- CH = C - CH3 propino
A partir de cuatro carbonos, es necesario poner un número para localizar la posición del enlace doble o triple.
Ejemplos:
CH2 = CH - CH2 - CH3 1-buteno
CH3 - CH = CH - CH3 2-buteno
CH = C - CH2 - CH3 1-butino
CH3 - C = C - CH3 2-butino
- Aromáticos:
Se les conoce también con el nombre genérico de ARENOS. Son el benceno y
todos sus derivados y, dependiendo del número de núcleos bencénicos,
pueden ser monocíclicos o policíclicos.
QUIMICA ORGANICA
Química orgánica
La Química Orgánica o Química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
La química orgánica se constituyó como disciplina en los años treinta. El desarrollo de nuevos métodos de análisis de las sustancias de origen animal y vegetal, basados en el empleo de disolventes como el éter o el alcohol, permitió el aislamiento de un gran número de sustancias orgánicas que recibieron el nombre de "principios inmediatos". La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban ‘la fuerza vital’, es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono e hidrógeno, y otros elementos (que pueden ser uno o más), siendo los más comunes: oxígeno, nitrógeno, azufre y los halógenos.
LA FORMACION DE LAS CADENAS DE CARBON
La Química Orgánica o Química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
La química orgánica se constituyó como disciplina en los años treinta. El desarrollo de nuevos métodos de análisis de las sustancias de origen animal y vegetal, basados en el empleo de disolventes como el éter o el alcohol, permitió el aislamiento de un gran número de sustancias orgánicas que recibieron el nombre de "principios inmediatos". La aparición de la química orgánica se asocia a menudo al descubrimiento, en 1828, por el químico alemán Friedrich Wöhler, de que la sustancia inorgánica cianato de amonio podía convertirse en urea, una sustancia orgánica que se encuentra en la orina de muchos animales. Antes de este descubrimiento, los químicos creían que para sintetizar sustancias orgánicas, era necesaria la intervención de lo que llamaban ‘la fuerza vital’, es decir, los organismos vivos. El experimento de Wöhler rompió la barrera entre sustancias orgánicas e inorgánicas. Los químicos modernos consideran compuestos orgánicos a aquellos que contienen carbono e hidrógeno, y otros elementos (que pueden ser uno o más), siendo los más comunes: oxígeno, nitrógeno, azufre y los halógenos.
LA FORMACION DE LAS CADENAS DE CARBON
Formas alotrópicas del carbono
Grafito:
Esta es una forma mas comunes del carbono, este posee una estructura
laminar que se encuentran separadas por capas, la fuerza entre ellas
es débil, esto hace que el grafito sea blando.
Diamante:
Esta una forma del carbono muy conocida, que se caracteriza por su alto
nivel de dureza y por su alta dispersión de luz, tiene una estructura de
cristal covalente tridimensional, que se encuentra formados por enlaces
de carbono interconectados, que se extienden por todo el cristal.
Fullereno:
Se forma cuando el grafito se vaporiza con un láser, esta forma permite
que el carbono pueda combinarse formando hexágonos y pentágonos y
estructuras tridimensionales cerradas, se presenta en formas esféricas;
el mas común de los fullerenos es el de C60 (de sesenta átomos de
carbono).
El Nanotubo de carbón
Es otra forma alotrópica del carbón, su estructura se puede considerar
como grafito enrollado en forma de tubo, pueden ser abiertos o cerrados.
La Nanoespuma.
Es otra forma alotrópica del carbono descuebierta en 1997; consiste en
un ensamblado de cúmulos de baja densidad de átomos de carbono,
mantenidos en una red tridimensional.
Esta es la estructura propuesta para la nanoespuma de carbón.
FUENTE:
IMAGENES:
INFORMACIÓN:
Química
Orgánica Fundamental, Rakoff, Editorial Interamericana, Segunda Edición 650 Pag
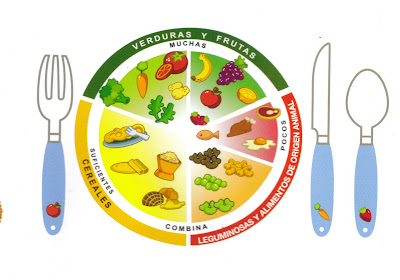
ESTAS COMIENDO BIEN?
Grupo de alimentos de acuerdo al “Plato del buen comer”
Alimento Verduras y frutas Cereales Leguminosas y alimentos de origen animal Otros Total
Coctel de frutas 3
Jugo de mango 2
Verdolagas en puerco 1 200g 1
tortilla 15
leche 1litro 1
Galletas ma-rias 5
Filete con tosino 200g
arroz 100g
cafe 2
pechuga 150g
huauzontle 2
queso 80g
Tacos past 160g
Pan dulce 1
arrachera 300g
Empanada queso 2
ensalada 2
limonada 4
Emparedado jamon 1
chocolate 1
Alimento Verduras y frutas Cereales Leguminosas y alimentos de origen animal Otros Total
Coctel de frutas 3
Jugo de mango 2
Verdolagas en puerco 1 200g 1
tortilla 15
leche 1litro 1
Galletas ma-rias 5
Filete con tosino 200g
arroz 100g
cafe 2
pechuga 150g
huauzontle 2
queso 80g
Tacos past 160g
Pan dulce 1
arrachera 300g
Empanada queso 2
ensalada 2
limonada 4
Emparedado jamon 1
chocolate 1
jueves, 9 de febrero de 2012
EL LIBRO
QUÍMICA, UNIVERSO, TIERRA Y VIDA
CAPÍTULO I
La vía Láctea, en donde se encuentra el Sol que nos alumbra, es parte del Universo. Algunos científicos han postulado que éste se formo a partir de una gran explosión, que dio lugar a un gas denso, y este a su vez, formó las diferentes galaxias.
Los primeros elementos que se formaron en el Universo fueron el hidrógeno (H) y el helio (He), pues son los más simples, posteriormente se fueron formando más. Estos dos elementos, son los que principalmente constituyen el Universo. El hidrógeno en un 90% y el helio en un 8% aproximadamente.
El hidrógeno, está formado por un núcleo (protón) con carga positiva, y ésta se neutraliza gracias a un electrón con carga negativa. Este elemento, se combina con otros para formar moléculas.
La Ley de las proporciones constantes indica que cuando dos elementos se juntan para formar un nuevo compuesto, siempre hay una constancia de masas. Así, si dos átomos de hidrógeno, cada uno con peso atómico 1, reaccionan con un átomo de oxígeno cuyo peso atómico es 16, se producirá agua con peso atómico 18.
El agua es un producto importante, debido a que forma parte de aproximadamente ¾ partes de la superficie del planeta tierra, y constituye más de la mitad del peso en los seres vivos. Es un líquido incoloro, inodoro e insípido, cuyas características lo hacen punto de referencia para medir las de otras sustancias.
Existe un compuesto con un átomo más de oxígeno que el agua, que se conoce como agua oxigenada o peróxido de hidrógeno (H2O2), el átomo extra que tiene de oxígeno es inestable por lo que con facilidad se libra para quedar como agua.
El hidrógeno se puede liberar de otras moléculas con las que forme elementos, al ser el agua el compuesto con hidrógeno más abundante, es lo primero en lo que se piensa para preparar hidrógeno; éste sólo tiene un electrón que se pierde con facilidad para dar iones positivos, así, al pasar corriente eléctrica a través del agua, los protones generados, serán atraídos hacia el polo negativo (cátodo), y así se liberará hidrógeno gaseoso.
Sin embargo, el agua es mala conductora de corriente eléctrica, por lo que se disuelven en ella bases o ácidos, como ácido nítrico, por ejemplo, a este proceso se le conoce como electrólisis.
También se puede obtener hidrógeno es mediante la descomposición de un ácido por medio de un metal.
Mediante la electrólisis, se pueden obtener metales, como es el caso del aluminio que hoy en día hay en todas las cocinas. El procedimiento por el cual se obtiene aluminio a partir de bauxita, fue descubierto por Charles M. Hall y por P.L.T. Heroult, y consiste en purificar la criolita, disolverla en una solución de criolita fundida y luego, esta solución colocarla en una tina de carbón a la que se insertan barras de grafito y se hace pasar corriente eléctrica a través del mineral fundido.
El helio que es el segundo elemento más abundante en el Universo, es inerte, debido a que no se combina con otros elementos; esto se debe a que tiene dos protones en su núcleo, y en su capa de electrones también hay dos, por este motivo ni recibe, ni da, ni comparte electrones con otros átomos.
Oparin propuso que la atmósfera de la tierra primitiva estaba compuesta de agua, amoniaco, hidrocarburos (principalmente metano) y ácido sulfhídrico. Esta mezcla de gases, al ser sometidos a altas temperaturas, a radiación solar directa, debieron dar origen a nuevas moléculas orgánicas como los aminoácidos. Así, el científico Miller, dio apoyo a la teoría de Oparin gracias al experimento en el que puso vapor de agua, metano, hidrógeno y amoniaco en un recipiente cerrado, sometido posteriormente a descargas eléctricas durante una semana; el resultado fue que se formaron ácidos orgánicos, aminoácidos y urea.
Bueno desde mi punto de vista, el capitulo primero es sumamente importante ,para darte una idea general del inicio del universo , los principales elementos
las cantidades de los mismos en el universo y como son algunas de las uniones de estos elementos,algunas formas de obtener elementos.
CAPÍTULO II
De la teoría antes mencionada sobre el origen del Universo, se cree que el átomo se formó dentro de las estrellas mediante la colisión de tres átomos de helio (el carbono tiene un peso atómico igual a doce, y el helio un peso atómico igual a cuatro).
El Sistema solar nació a partir del polvo cósmico y gas, conforme este fue enfriándose se fueron formando los planetas. Cada planeta tiene diferente composición química debido a en qué región de la nebulosa se formó, con sus consecuentes diferencias de temperatura.
Existen elementos hechos artificialmente por el hombre que se llaman transuránicos, logran hacerlos colisionando distintos átomos. Cuando la colisión se lleva a cabo entre átomos y neutrones, se obtienen átomos con el mismo número atómico, pero diferente peso molecular que se llaman isótopos.
Todos los elementos pueden tener un número variable de isótopos, por ejemplo, el uranio tiene 92 protones y 143 neutrones, por lo que tiene el isótopo uranio 235 (92+143=235).
El carbono en la Tierra se puede encontrar de dos maneras: libre, en diamantes y grafito, ó combinado, como en polvo para hornear, el algodón ó el azúcar.
En el diamante, cada carbono se encuentra unido por otros cuatro localizados en los vértices de un tetraedro (poliedro de cuatro caras). En el grafito, la distribución del carbono es diferente, pues los carbonos están unidos a tres átomos vecinos formando capas de hexágonos, estas capas tienen una fuerza de unión débil por lo que permite que una capa pueda deslizarse sobre otra.
En su primer época, la atmósfera de la Tierra fuer rica en hidrógeno, por lo que el carbono que también había reaccionó con este formando hidrocarburos. Los hidrocarburos lineales tendrán la fórmula CnH2n+2. Esta fórmula también se aplica a los hidrocarburos ramificados, no así en los cíclicos; estos se representan por medio de polígonos y cada ángulo representa un CH2.
El carbono tiene cuatro valencias, que también pueden ser utilizada para unir dos átomos de carbono entre sí, usando una, dos o tres valencias. Cuando usan dos valencias, se obtienen olefinas o alquenos, entre las que la más sencilla es el etileno. Cuando dos átomos de carbono se unen de sus tres o cuatro valencias se forman los alquinos, del cual el más sencillo es el acetileno.
El acetileno, combinado con metales forma sustancias duras llamadas carburos.
Los carburos metálicos se forman por la interacción entre el átomo de carbono y un óxido metálico a temperaturas altas. Los metales alcalinos forman carburos representables.
como M2C2, en donde M es metal; ahora bien, los alcalino térreos forman carburos representados por MC2.
Hemos expuesto sobre algunas de las combinaciones que tiene el carbono con otros elementos, sin embargo, los carbonos no sólo se pueden combinar entre sí y
con hidrógeno, sino también con otros elementos como el oxígeno y el nitrógeno, y así transformar compuestos orgánicos.
El metano es la unión de un átomo de carbono y cuatro de hidrógeno, es el hidrocarburo más sencillo. Es un gas inflamable y combustible eficaz. Este gas forma parte de la atmósfera de planetas como Júpiter, Neptuno, Urano y Plutón.
En la atmósfera de Júpiter se encuentra metano en estado gaseoso, pero por transformaciones químicas debidas a la radiación ultravioleta del sol, se hacen partículas de hidrocarburos más pesadas, que después se precipitan en forma de lluvia o nieve durante las tormentas eléctricas. Estos hidrocarburos, al caer al océano de Júpiter que es de hidrógeno líquido, se vuelven a reducir en metano e incorporarse a la atmósfera.
En la atmósfera de Saturno predomina el hidrógeno, aunque también es rica en metano, etano y amoniaco; estos últimos en estado sólido. La luna más grande de Saturno, Titan está formada por 80% nitrógeno y por metano, etano, acetileno y ácido cianhídrico. El metano puede estar presente tanto en sólido, líquido o gaseoso. Esta luna, tiene sustancias orgánicas debido a la reacción entre el metano y el nitrógeno, y al llevarse a cabo reacciones químicas, se forman ácido cianhídrico, ciano acetileno, etanopropano, etileno y metil acetileno, cuya importancia radica en ser sustancias intermediarias en la formación de aminoácidos y ácidos nucleicos, precursores de la vida.
Urano es un planeta gigante, cubierto con una capa de agua, amoniaco y metano, con atmósfera de hidrógeno y helio, así como una considerable cantidad de metano, justamente a eso debe su color verdoso.
Neptuno es muy parecido en cuanto a composición y tamaño que Urano.
Plutón tiene una composición química de agua sólida (74%), metano (5%) y roca (21%).
Debido a las bajas temperaturas y ausencia de oxígeno tanto de Urano como de Neptuno, se imposibilitan reacciones químicas en la atmósfera de dichos planetas.
Los cometas son cuerpos celestes formados de hielo, gas y polvo, que al ser perturbados por aluna estrella, se empiezan a mover y con el calor del Sol liberan gases y polvo.
Las órbitas de estos se pueden alterar debido a la influencia gravitacional de los planetas, siendo así cometas que pasan cada cierto tiempo, como el cometa Halley, que pasa cerca de la Tierra cada 76 años.
Este cometa pasó en marzo de 1986, y gracias a su estudio se obtuvieron datos como que el núcleo es alargado, que tiene una superficie muy oscura y que tiene perforaciones en la costra por donde salen gas y polvo, constituidos principalmente por vapor de agua, amoniaco, metano y bióxido de carbono. También fue encontrado que el cometa respira hidrógeno.
En un principio, en la atmósfera de la Tierra no había suficiente oxígeno que permitiera la combustión, sin embargo al transcurso de millones de años la cantidad de oxígeno se elevó para permitir la combustión, que es una reacción de oxidación en la que el hidrógeno se combina con el oxígeno del aire, produciendo agua, cuya reacción además produce luz y calor.
Cuando un hidrógeno de un hidrocarburo se sustituye por un oxhidrilo (OH) se obtiene un alcohol. Al aumentar el número de átomos de carbono, la molécula adquiere más características de hidrocarburo, siendo más diferente al agua. Ahora bien, los átomos de oxígeno de una molécula de alcohol, atraen a su vez a una segunda molécula de alcohol.
El alcohol metílico se obtiene de la destilación seca de la madera, y es venenoso, por lo que se tiene que ser precavido, pues si se ingiere, se respira o se toca por periodos prolongados puede provocar ceguera ó muerte.
El alcohol etílico, en cambio, se produce gracias a la fermentación de líquidos azucarados, pero al ser común su uso para bebidas alcohólicas, para usos industriales se le pone un sabor u olor desagradable.
Existe también la posibilidad de insertar un oxígeno entre dos átomos de carbono, obteniendo los éteres. El éter metílico es el más sencillo (CH3OCH3). Se usa como anestésicos y como disolvente volátil y no mezclable en el agua.
Existen alcoholes primarios, secundarios y terciarios. Los primarios pierden por oxidación dos átomos de hidrógeno dando lugar a un aldehído. En el caso del alcohol metílico, dará lugar a formol, que se utiliza para la conservación de cadáveres.
Para hacer un espejo de plata, se prepara nitrato de plata amoniacal, agregando amoniaco disuelto en agua a una solución de nitrato de plata, hasta que el precipitado de hidróxido de plata formado en un inicio se disuelva, una vez preparado el nitrato de plata amoniacal, se agrega formol.
El formaldehido forma dos tipos de polímeros, uno cuyos átomos de carbono de una molécula se unen con los átomos de oxígenos de otra, y otro tipo cuando las moléculas se unen por medio de los átomos de carbono.
Cuando el OH no se encuentra al final de la cadena como en el etano, sino que está sobre un átomo central, la oxidación da origen a las cetonas; así, la oxidación de isopropanol da lugar a la acetona. Ahora bien, cuando la oxidación de un aldehído continúa, se obtiene un ácido carboxílico.
En mi humilde opinión, lo mas relevante es como se plantea la cracion de los atomos, cosa que no sabia,la craqcion del sistema solar , de la atmosfera y la importancia del hidrogeno y oxigeno en la misma,
CAPÍTULO III
En el Sol se generan grandes cantidades de energía, que se propaga por el espacio a una velocidad de 300 000 km por segundo, por lo que llega la tierra en ocho minutos después de su generación. Las radiaciones viajan como ondas a la velocidad de la luz, y tienen algunas características, como la longitud de onda (distancia entre dos máximos), frecuencia (número de ondas que pasan por cada segundo). Así, mientras menor sea la longitud, será mayor la frecuencia y viceversa, pues la frecuencia es inversamente proporcional a la longitud de onda.
Las radiaciones con más frecuencia, también tienen más energía.
Lo que el hombre puede ver, la “luz visible” se compone por radiaciones de poca energía desde 400 a 800 nanómetros. La luz de menor longitud de onda a 400 es violeta, siguiéndole el color azul, después sigue la luz verde, la amarilla, la anaranjada y la roja con la que termina el espectro visible para el ojo humano. Este espectro, es muy pequeño debido a que existen ondas que pasan desapercibidas para nuestro ojo, como los rayos X, los rayos gama, la luz infrarrojo, las ondas de radio o las microondas.
Cuando en la Tierra la atmósfera estaba más expuesta a la radiación ultravioleta, las moléculas de agua se descomponían en hidrógeno y oxígeno, parte de este oxígeno se activaba por la radiación ultravioleta, transformándose en ozono, de tal forma que así se fue formando una capa protectora contra la radiación ultravioleta, la capa de ozono, que no hace función de filtro a las radiaciones ultravioleta que son dañinas para la vida.
Cuando una molécula es excitada, el fotón absorbido la hará pasar a un estado de excitación, que cuando se relaja en un estado vibracional o rotacional antes de llegar a su estado basal, emitirá luz de menor energía que la absorbida, a este proceso se le llama fluorescencia.
Otra forma de que se relaje es la que se lleva a cabo en el proceso de la visión.
Un ejemplo más de la reacción química que provoca la luz, es la formación de vitamina D2. Se trata de una transformación fotoquímica de ergosterol en vitamina D2.
La luz solar se puede utilizar también para convertirla en energía eléctrica, el procedimiento se basa en la propiedad de la energía luminosa de excitar los electrones de los átomos. Cuando a un cristal de silicio se le pone luz, los átomos serán excitados y los electrones podrán abandonar el átomo, dejando un hueco que equivale a una carga positiva, que a su vez atraerá un electrón del átomo vecino, generándose así una cadena sucesiva de lo antes descrito.
Las plantas que realizan fotosíntesis, tienen membranas que son una bicapa de lípidos antipáticos especialmente fostolípidos, presentan hacia el exterior la parte polar cargada y en el interior las partes no polares.
La molécula sensibilizadora en la fotosíntesis es la clorofila, que es un anillo tetrapirrólico con un átomo de Mg en el centro; la clorofila absorbe luz para iniciar la reacción de la fotosíntesis. A parte de clorofila, también existen otros pigmentos como carotenos y xantofilas, que ayudan a absorber longitudes de onda que la clorofila no puede.
A pesar de que todas estas moléculas pueden absorber la luz, sólo hay una que transforma la energía luminosa en química, y es el centro de reacción fotoquímica, que es una clorofila combinada con una proteína específica.
La ecuación total de la fotosíntesis es:
2 H2O+4 hv→ O2+4H++4e-
Los organismos fotosintéticos también pueden producir glucosa y otros azúcares a partir del CO2 atmosférico.
Pienso que este capitulo habla de la importancia del sol, sus ondas, características de las ondas, tipos rayos, nuestra poca capacidad para percibirlas y como las plantas necesitan del sol para sus funciones.
CAPÍTULO IV
Gracias a las algas verde-azules y vegetales fotosintéticos, la atmósfera de la tierra cambio de reductora a oxidante. Así, se libera oxígeno a partir de la reacción de fotosíntesis utilizando la luz solar como fuente de energía. Al haber más oxígeno en la atmósfera, se prestaron las condiciones para que apareciera un tipo de vida que toma la materia orgánica que elaboran los vegetales y por medio de una reacción de oxidación liberan la energía necesaria para realizas sus funciones, después, el bióxido de carbono regresa a la atmósfera en donde se volverá a iniciar el ciclo en el que los vegetales lo empleen.
Los vegetales por medio de la fotosíntesis acumulan 282 kilocalorías en una molécula de glucosa, los animales, para liberar estas kilocalorías contenidas en la molécula de glucosa, utilizar la hemoglobina, que tiene el mismo esqueleto de la clorofila, difiriendo solamente que la hemoglobina en vez de magnesio tiene fierro. La hemoglobina, toma oxígeno y lo transporta a los tejidos para realizar el proceso contrario al de la fotosíntesis.
Es así como se complemente el círculo, pues el CO2 que toman los vegetales de la atmósfera regresa a ella.
Así como el oxígeno, hay otras sustancias que el humano necesita, tal es el caso del calcio y el fósforo.
El cerebro es uno de los órganos más importantes que poseemos, y que nos ha permitido diferenciarnos a otras especies, es por eso que tiene cierto privilegio con respecto a otros órganos, por lo que recibe glucosa pura como fuente de energía y consume casi el 20% total de oxígeno. El cerebro requiere la glucosa para mantener el potencial eléctrico de las membranas del plasma.
El opio es una sustancia que ha sido utilizada como analgésico, y la morfina que es uno de los constituyentes del opio tiene efectos tales como calmar el dolor, ocasionar euforia, regular la respiración y como antidiarréica, sin embargo, es una sustancia que también causa dependencia; la dependencia de ella se debe a la existencia de receptores de morfina en el cerebro.
Uno de los pasos fundamentales del hombre fue el descubrimiento y dominio del fuego, siendo la primera reacción química que domina a voluntad. Inicialmente fue aplicado a la cocción de alimentos y después a la fabricación de utensilios de arcilla.
El hecho de que las cosas con el tiempo se desgasten y hagan feas, tiene mucho que ver con el oxígeno, con el proceso de oxidación, que también afecta a los seres vivos. Los radicales libres están implicados en el proceso de envejecimiento del humano.
Basicamente este capitulo trata de cómo la tierra paso de reductora a oxidante por medio de las plantas y vegetales que es algo muy interesante, las propiedades alimenticias de las mismas , el ciclo del carbono, y alimentos que el ser humano necesita.retomando que los alimentos son elementos y moléculas.es muy padre como todo afecta nuestro entorno para la vida.
CAPÍTULO V
Como mencionamos antes, el dominio del fuego sirvió al hombre de mucho, uno de sus usos, el de fabricar recipientes de arcilla permitió calentar agua, cocinar alimentos y hacer infusiones; es así que encuentra en las plantas no sólo alimento, sino también uso medicinal, como colorantes o como aromatizantes.
El conocimiento de los pueblos americanos sobre las plantas era tan amplio que llegó a interesar al rey de España Felipe II, que solicitó una investigación médico-botánica por parte de Francisco Hernández que dio lugar a la descripción de 3076 plantas con sus usos medicinales, así como un amplio recuento de animales y minerales.
Muchas plantas utilizadas en ritos mágicos o religiosos continúan utilizándose; como es el caso del peyote que es un cactus que al ser comido, crea resistencia ante la fatiga, calma el hambre y la sed además de hacer entrar al individuo en un mundo fantasioso.
Otra planta con uso medicinal es el ololiuqui, que es útil contra la gota. Su principio activo radica en alcaloides de tipo del ácido lisérgico.
Los hongos que tienen un efecto alucinógeno también fueron utilizados en ritos y su uso continúa hasta nuestros días.
El curare es un extracto acuoso de varias plantas, estas se ponen a hervir en una olla de barro, se agregan otras sustancias venenosas como hormigas y colmillos de serpiente y cuando tiene cierta consistencia se reparte entre los presentes para su uso en la cacería. Con lo obtenido, se impregnan puntas de flecha o dardos de
cerbatanas. Entre las plantas que se utilizan para su preparación se encuentran diversas especies de Strychnos, que son muy venenosas debido a su contenido de alcaloides.
A pesar del uso medicinal que se le daba a algunas plantas, tuvo que pasar mucho tiempo para que las sustancias activas pudiesen ser aisladas y dosificadas. Fue gracias a Lavoisier que elaboró un método para analizar compuestos orgánicos; al medir el CO2 producido podía saber cuántos átomos de carbono tenía una molécula, y para saber la cantidad de hidrógeno se medía el agua obtenida.
Fue así que se empezaron a aislar los principios activos y posteriormente se fueron perfeccionando las técnicas y los conocimientos, llegando a encontrar no sólo la conformación en cuanto a cantidad sino en cuanto a forma.
En 1828 el químico Friedrich Wöhler demostró que la síntesis de compuestos orgánicos era posible de hacer por el ser humano, lo que permitió simplificar de alguna manera la producción de algunas medicinas.
Este capitulo es mas corto q los anteriores pero igualmente interesante, retoma la idea de lo que el hombre pudo hacer con el decubrimiento del fuego, y como a lo largo de la historia se fueron utilizando las plantas medicinales hasta lograr obtener las sustancias que posteriormente originaron a las medicinas.
CAPÍTULO VI
La fermentación es una reacción que ocurre de manera espontánea provocada por microorganismos, y es un proceso conocido desde hace mucho tiempo, produciéndose el vino.
El pulque, es un producto de la fermentación del aguamiel, y fue el equivalente del vino, pero en Mesoamérica. Es una bebida utilizada en rituales y en importantes ceremonias religiosas, a esta bebida también se le llama octli y a juzgar por los testimonios de diversos códices tuvo gran importancia, sin embargo a la llegada de los españoles pasó a tener una degradación, convirtiéndose en la bebida de los pobres.
El procedimiento para su obtención, consiste en recolectar el aguamiel y colocarlo en un recipiente de cuero, donde se lleva a cabo la fermentación provocada por la flora natural del agua miel. La fermentación va siendo controlada al vigilarse la viscosidad y sabor para saber en qué momento debe de suspenderse la fermentación. Posteriormente, se envasa en barriles de madera y se distribuye en las pulquerías. Su contenido alcohólico es de aproximadamente 4.26%.
El colonche es otra bebida alcohólica obtenida mediante la fermentación del jugo de tuna. Su elaboración consiste en recolectar las tunas, pelarlas, exprimirlas y colarlas, y el jugo obtenido se hierve y se deja reposar para que surta efecto la fermentación de manera espontánea.
El tesgüino es un fermentado de maíz germinado que en pueblos indígenas tiene un importante uso ceremonial.
El pozol es una bebida de maíz molido fermentado, a la que se puede agregar sal y chile, azúcar o miel.
Para la fermentación alcohólica a nivel industrial se utilizan sustratos con alto contenido en azúcares. Las levaduras, que son los microorganismos responsables
de la fermentación, no sólo se utilizan para la obtención de productos alcohólicos, sino también para la fabricación de pan; lo que ocurre es también un a fermentación que da lugar a bióxido de carbono, siendo el gas que esponja la masa y le da un aspecto suave.
La leche también puede pasar por un proceso de fermentación para dar lugar a alimentos como el yogurt y el queso, la acidez de estos alimentos o de la leche fermentada se debe al ácido láctico. Gracias a la fermentación por distintos microorganismos, se pueden obtener diferentes productos.
En otros ámbitos, las reacciones que llevan a cabo los microorganismos han sido útiles para obtener diferentes compuestos, como es el caso de la testosterona a partir de la androstenolona. Las fermentaciones también se han utilizado para la obtención de corticoides. La obtención de estas sustancias es importante debido a sus usos en el tratamiento de múltiples enfermedades.
En mi opinión lo mas importante de la fermentación que es una reacción provocada por microorganismos es la producción de las bebidas alcoholicas y medicinas.
CAPÍTULO VII
Debido a que el agua y el aceite no se mezclan, el agua suele ser insuficiente para limpiar la grasa, por lo que nos tenemos que ayudar de jabón o detergente; el efecto de estos productos se debe a que en su molécula existe una parte lipofílica por medio de la cual se unen a la grasa o aceite, mientras que la otra parte hidrofílica se une al agua, así el jabón toma la grasa y se la lleva al agua.
Los aceites vegetales cuando son tratados con una base fuerte como sosa o potasa se saponifican, producen jabón y liberan glicerina. Cuando la saponificación se lleva a cabo con sosa se obtienen jabones sólidos, y cuando se hace con potasa se obtienen jabones líquidos. A veces, se agrega brea para obtener jabones más solubles y apropiados para lavar ropa.
El proceso para fabricar jabón consiste en colocar el aceite o grasa en un recipiente de acero inoxidable para ser calentado con un serpentín perforado por el que circula vapor, así cuando la grasa se ha fundido se agrega una solución de sosa, se continúa agitando hasta obtener la saponificación total y se agrega sal para que el jabón se separe y quede flotando.
El agua dura, que contiene calcio u otros metales, no sirve para cocer las verduras ni para disolver el jabón, esto ocurre al reaccionar el jabón con las sales disueltas y producir jabones insolubles. El agua dura, por lo tanto ocasiona que la cantidad utilizada de jabón sea mucho mayor, y que no se produzca espuma.
Debido a que en algunos lugares como en Alemania el agua es muy dura, se descubrió la manera de hacer detergentes sintéticos, que al utilizarse con este tipo de agua provocaban abundante espuma y no formaban sales insolubles. Gracias a estas ventajas del detergente sintético, su uso se ha popularizado, sin embargo, han ocasionado un problema de contaminación debido a que la mayoría no son degradables; por tal motivo, se han hecho sustituciones de la cadena lateral ramificada por una lineal para que así, sea biodegradable.
Antes del uso del jabón comercial, se utilizaban jabones naturales llamados saponinas, conocidos por los mexicanos como amole. Proviene de muchas raíces
y follaje de plantas, que hacen espuma con el agua. Las sapopinas contienen una parte lipofílica (esteroide o triterpeno) y una parte hidrofílica (azúcar)
Entre las saponinas de naturaleza esteroidal, son importantes los glicósidos cardiacos, útiles en el tratamiento de enfermedades del corazón.
Para mi este es el capitulo mas aburrido, solo hable de el agua y procesos de fabricacion de los detergentes y jabones.
CAPÍTULO VIII
Las plantas al igual que los humanos, necesitan hormonas; las que regulan su crecimiento y germinación (fitohormonas), las que se forman cuando está en la superficie (auxinas) que aceleran su crecimiento vertical, las que se encargan de la ramificación de la planta (citocininas). La planta también contiene inhibidores que ocasionan que sus hojas caigan, las sustancias responsables se llaman ácidos abscísicos.
Las plantas grandes producen sustancias que los hacen poco digeribles como los taninos y las ligninas, y las plantas pequeñas, tienen sustancias tóxicas como los alcaloides.
Los movimientos de las plantas son provocados por sustancias químicas, por ejemplo los girasoles se contraen en el sitio donde les da la luz porque se forman inhibidores de crecimiento en ese punto.
En los insectos y plantas existen tres tipos de mensajeros químicos:
-Las alomonas son sustancias que toman los insectos para uso defensivo, como ejemplo tenemos la mosca de los pinos, que toma de estos una sustancia que escupe cuando es atacada.
-Las kairomonas son sustancias emitidas por un insecto que atraen a ciertos parásitos que lo atacarán, es probable que estas sustancias sean producidas por la planta de la que se alimenta el insecto herbívoro, y que una vez en su sistema atrae al parásito.
-Las feremonas son sustancias por las cuales se envían mensajes de atracción sexual, alarma, etc.
Algunos mamíferos producen secreciones que les sirven para marcar territorio, identificar la especie o sexo; estas sustancias se encuentran en ciertas glándulas, en la orina o en las heces. Así mismo, el interés por el sexo opuesto en los animales es despertado por el olor, como también la capacidad de distinguir a un individuo entre miles.
Los seres humanos producimos hormonas, entre las cuales se encuentras las sexuales, que son producidas y excretadas por los órganos sexuales.
Las hormonas masculinas (andrógenos) son las que provocan el crecimiento de barba y bigote, así como ciertos comportamientos.
Las hormonas masculinas (estrógenos) son producidas en el ovario y son las que provocan su forma redondeada.
También existen sustancias sintéticas que funcionan como hormonas, son el estilbestrol y el hexestrol, sin embargo, al ser tóxicas sólo se utilizan en la veterinaria y no con humanos.
La progesterona es una sustancia producida por el cuerpo amarillo del ovario que evita la ovulación. Así, se buscó su síntesis y al lograrse, se inicio la era de la anticoncepción por medio de la píldora.
La testosterona, por otra parte, al quitársele un átomo de carbono, y luego se le adiciona un par de átomos de carbono, se obtiene un potente anticonceptivo.
La testosterona favorece el desarrollo muscular, sin embargo tiene un efecto masculinizante por lo que se necesitan sustancias con propiedades similares, pero que no estimulen la hormona sexual, tal es el caso de la 19-norestestosterona. Existen otras sustancias con efecto anabólico que en ocasiones es utilizado por atletas; sin embargo pueden tener efectos secundarios como acné, mal humor, tumores, daños al hígado, calvicie, alteración en el deseo sexual, agrandamiento de busto (en hombres), crecimiento de vello en la cara (mujeres), irregularidades en el ciclo menstrual.
Las saponinas de las que hablamos anteriormente, son importantes para la elaboración de drogas esteroides de gran utilidad; es así como utilizan sustancias vegetales para convertirlas en hormonas sexuales.
La yuca filifera es materia prima para la obtención de saponinas esteroides, llamadas filiferinas, que pueden ser transformadas en hormonas sexuales y corticoides.
Bueno el libro mas o menos tenia cosas interesantes, pero se revolvió mucho con esto de las hormonas en las plantas y seres humanos, algo que no tenia mucho que ver con lo anterior.
CAPÍTULO IX
En la Tierra siempre ha existido la lucha por el espacio, la comida y el agua; sin embargo algunas especies logran llegar a un punto simbiótico en el que se ayudan mutuamente, tal es el caso de las abejas que toman el polen de las flores, pero que a su vez, ayudan a la polinización de estas.
Algunos insectos, con fines de protección tienen aguijones conectados a glándulas que producen sustancias tóxicas, como las avispas o las abejas. Otros insectos, escupen estas sustancias, como el caso del escarabajo bombardero; éstos son casos de armas químicas utilizadas por los insectos. Sin embargo, algunos mamíferos también cuentan con este tipo de armas, como es el caso del zorrillo.
El hombre, a pesar de no poseer glándulas productoras de sustancias tóxicas, también ha utilizado la química para destruir a su enemigo. En un inicio se utilizó el fuego, posteriormente los explosivos, que al principio eran una mezcla de salitre, azufre y carbón, y que posteriormente fueron más poderosos, siendo productos de nitratdos.
En la Segunda Guerra Mundial, se utilizó el trinitrotolueno o TNT, que se obtiene mediante el tratamiento del tolueno con mezcla sulfonítrica.
Después, se utilizó la bomba de uranio que fue lanzada sobre Hiroshima; y en la Primera Guerra Mundial, los alemanes utilizaron nubes de cloro, y durante esta guerra también fue utilizado el gas mostaza.
Las sustancias químicas, no sólo han sido utilizadas de la manera anterior, sino también para el espionaje. El aldehído aromático ha sido utilizado para marcar el camino de personas sometidas a investigación, al tener contacto con el polvo, la persona después dejará rastro de este que es detectado en los objetos.
Los herbicidas, auxiliares para la exterminación de maleza en el cultivo, se utilizó en Vietnam, al combinarse dos herbicidas, para dar origen al agente naranja. El
propósito era que los árboles perdieran sus hojas para que el enemigo no pudiera esconderse entre la maleza. Sin embargo, se ha visto que territorios expuestos se volvieron áridos, y que la población ha mostrado malformaciones y desarrollado cáncer.
La lluvia amarilla, es lluvia ácida, que provoca irritación de la piel, vómitos, diarrea, temblores y muerte; en 1981, se encontró que era provocada por armas rusas. Las micotoinas que se encuentran en la lluvia ácida son producidas por el hongo del género Fusarium. La polémica sobre si este tipo de lluvia es producida por el hombre o no se llevó al “Primer Congreso Mundial sobre Nuevos Compuestos en Guerra Química y Biológica”, en donde Matthew Meselson aseguró que es un fenómeno natural.
Con el uso de sustancias tóxicas a veces ocurren accidentes, como el que sufrió la planta insecticida de Bhopal en la India, en el que un tanque se calentó aumentando la presión y provocando su liberación violenta de toneladas de isocianato de metilo.
Mi opinión general de este libro es que en general contiene información valiosa pero sumamente revuelta, salta muy rápido las etapas y tipos de información.
Buen libro pero confuso.
QUIMICA,UNIVERSO,TIERRA Y VIDA
ALFONSO ROMO
FONDO DE CULTURA
COLECCION DE LA CIENCIA DESDE MEXICO
Suscribirse a:
Entradas (Atom)









