QUIMICA ORGANICA
T.J THOMPSON
LIMUSA
1997
PRINCIPIOS DE QUIMICAINORGANICA
BROWN
IBEROAMERICANA
2006
QUIMICA
ANTONIO RICO
UNAM 2010
lunes, 7 de mayo de 2012
domingo, 6 de mayo de 2012
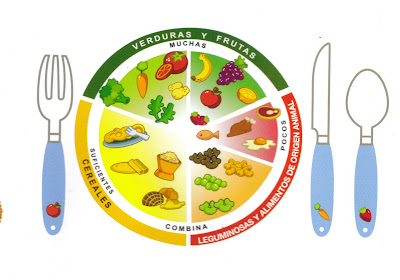
MI DIETA
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS
CARBOHIDRATO
Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas,
Azucares, helados.
LIPIDOS
GRASAS
ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite,
PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas
VITAMINAS
Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras
FIBRAS
Aceleración del proceso digestivo 25g Cereales y verduras
MINERALES
Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS CARBOHIDRATO Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas, Azucares, helados. LIPIDOS GRASAS ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite, PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas VITAMINAS Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras FIBRAS Aceleración deh proceso digestivo 25g Cereales y verduras MINERALES Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.
NUTRIMENTO GRUPO FUNCIONAL ESTRUCTURA FUNCION EN ORGANISMO CONSUMO 15-17 AÑOS TIPO DE ALIMENTOS CARBOHIDRATO Generan calorías, energía para el funcionamiento 1g por peso ideal Panes, tostadas, Azucares, helados. LIPIDOS GRASAS ACEITES Producen energía , paredes celulares, tejido adiposo, conservar temperatura 185g Tocino, aceite, PROTEINAS Sintetizar sustancias químicas en el cuerpo, como contracción muscular, formación hemoglobina, etc., genética células 2g por peso ideal Leche, pollo, huevo, carnes rojas VITAMINAS Fortalecimiento de huesos, mejoramiento de la piel, recubrimiento del sistema nervioso, ayuda a la metabolización. 85-92g Frutas y verduras FIBRAS Aceleración deh proceso digestivo 25g Cereales y verduras MINERALES Controlan las hormonas que liberan las tiroides, producción glóbulos rojos 10-35g Sal, agua etc.

LIPIDOS
Clasificaciones y estructuras.
Los mono y diglicéridos se encuentran en cantidades escasas. Aunque un triglicérido puede estar integrado por tres moléculas idénticas de ácidos grasos, también puede estar formada por tres ácidos grasos diferentes. La mayor parte de los ácidos grasos proviene de la hidrólisis de las moléculas de triglicéridos. Las enzimas que catalizan esta reacción en las células, se llaman esterasas o más específicamente lipasas. Las grasas neutras con alto contenido de ácidos grasos insaturados son líquidas, como los aceites comestibles. Si predominan los saturados, las grasas son sólidas, como sucede con las mantecas y las margarinas. Por cada gramo de grasaque se oxida, se obtienen nueve calorías, mientras que sólo se obtienen cuatro calorías al oxidar un gramo de carbohidratos o proteínas. Los fosfolípidos.
Los fosfolípidos o fosfoglicéridos aparecen casi exclusivamente en las membranas celulares, sólo una pequeña parte se encuentra en los depósitos de grasa. Los fosfolípidos tienen cierto parecido estructural con las grasas, prque están compuestos por una molécula de glicerol que tiene dos moléculas de ácidos grasos esterificadas; en lugar del tercer ácido graso se encuentra una molécula de ácido fosfórico. El glicerol, los ácidos grasos y el ácido fosfórico, forman el ácido fosfatídico. Los fosfolípidos deben su naturaleza anfifílica porque tienen una zona polar, representada por el glicerol, el ácido fosfórico, y la otra molécula; y otra zona apolar, constituida por las cadenas de átomos de carbono. La porción apolar es rechazada y la porción polar es atraída por el agua.
COMO AFECTA EL CALOR
***Cómo afecta el calor a...
Sustancias orgánicas: (pan, azúcar, harina) Sustancias inorgánicas (sal, agua) Estas sustancias se clasifican en orgánicas e inorgánicas, ya que en mi opinión las que se queman o contienen cargón son orgánicas, y las que no lo contienen son inorgánicas. Observaciones: El pan, el azúcar y la harina, con el calor se quemaron, unos más que otros, y otros más rápido, pero se queman debido al carbón. En la sal y el agua, como la primera es un mineral y la segunda no tiene carbón, no se queman, pueden cambiar de estado, pero químicamente son las mismas. Conclusiones: Para ser una sustancia orgánica se necesita quemarse, sino, será inorgánica, en éso radica la importancia del conocimiento de las mismas.

OXIDACIÓN Y REDUCCIÓN. Debido a la importancia de los procesos de pérdida y ganancia de electrones, éstos reciben nombres especiales. -La pérdida de electrones por un átomo o ion se llama oxidación -La ganancia de electrones por un átomo o ion se llama reducción Estos dos procesos siempre ser verifican al mismo tiempo. La pérdida y la ganancia de electrones son sólo los resultados de la transferencia de electrones. Las reacciones que implican la transferencia de electrones se llaman a menudo reacciones redox. la palabra redox es la abreviatura de reducción-oxidación Algunas veces una reacción particular recibe el nombre de oxidación o reducción; por ejemplo, la reacción: 2Ca(s)+O2(g) → 2Ca2+(s) +2O2-(s) puede llamarse oxidación del calcio. Esto no significa que no se efectúe la reducción. Significa que al químico le interesa más lo que sucede con los átomos de calcio. Por lo general, cuando un metal reacciona con oxígeno u otro no metal reactivo, la red metálica pierde electrones, de modo que el metal se oxida. En la reacción anterior, el calcio se oxidó. En la reacción siguiente, se oxida el magnesio: Mg(s)+Cl2(g) →Mg2+(s)+2Cl-(s) Del mismo modo un no metal se reduce cuando reacciona con un metal: los átomos del no metal ganan electrones. En los dos últimos ejemplos se redujeron el oxígeno y el cloro. COMBUSTIÓN La combustión es una reacción química en la cual, generlamente se desprende una gran cantidad de calor y luz. En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente) el cual es generalmente oxígeno en forma de O2 gaseoso. En una reacción completa todos los elementos tienen el mayor estado de oxidación. En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas. Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define comk, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente. La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión. .
Sustancias orgánicas: (pan, azúcar, harina) Sustancias inorgánicas (sal, agua) Estas sustancias se clasifican en orgánicas e inorgánicas, ya que en mi opinión las que se queman o contienen cargón son orgánicas, y las que no lo contienen son inorgánicas. Observaciones: El pan, el azúcar y la harina, con el calor se quemaron, unos más que otros, y otros más rápido, pero se queman debido al carbón. En la sal y el agua, como la primera es un mineral y la segunda no tiene carbón, no se queman, pueden cambiar de estado, pero químicamente son las mismas. Conclusiones: Para ser una sustancia orgánica se necesita quemarse, sino, será inorgánica, en éso radica la importancia del conocimiento de las mismas.

OXIDACIÓN Y REDUCCIÓN. Debido a la importancia de los procesos de pérdida y ganancia de electrones, éstos reciben nombres especiales. -La pérdida de electrones por un átomo o ion se llama oxidación -La ganancia de electrones por un átomo o ion se llama reducción Estos dos procesos siempre ser verifican al mismo tiempo. La pérdida y la ganancia de electrones son sólo los resultados de la transferencia de electrones. Las reacciones que implican la transferencia de electrones se llaman a menudo reacciones redox. la palabra redox es la abreviatura de reducción-oxidación Algunas veces una reacción particular recibe el nombre de oxidación o reducción; por ejemplo, la reacción: 2Ca(s)+O2(g) → 2Ca2+(s) +2O2-(s) puede llamarse oxidación del calcio. Esto no significa que no se efectúe la reducción. Significa que al químico le interesa más lo que sucede con los átomos de calcio. Por lo general, cuando un metal reacciona con oxígeno u otro no metal reactivo, la red metálica pierde electrones, de modo que el metal se oxida. En la reacción anterior, el calcio se oxidó. En la reacción siguiente, se oxida el magnesio: Mg(s)+Cl2(g) →Mg2+(s)+2Cl-(s) Del mismo modo un no metal se reduce cuando reacciona con un metal: los átomos del no metal ganan electrones. En los dos últimos ejemplos se redujeron el oxígeno y el cloro. COMBUSTIÓN La combustión es una reacción química en la cual, generlamente se desprende una gran cantidad de calor y luz. En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión (comburente) el cual es generalmente oxígeno en forma de O2 gaseoso. En una reacción completa todos los elementos tienen el mayor estado de oxidación. En la combustión incompleta los productos que se queman pueden no reaccionar con el mayor estado de oxidación, debido a que el comburente y el combustible no están en la proporción adecuada, dando como resultado compuestos como el monóxido de carbono (CO). Además, pueden generarse cenizas. Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada temperatura de ignición, que se define comk, en °C y a 1 atm, temperatura a la que los vapores de un combustible arden espontáneamente. La temperatura de inflamación, en °C y a 1 atm es aquella que, una vez encendidos los vapores del combustible, éstos continúan por si mismos el proceso de combustión. .
LA QUIMICA Y LA SUSTITUCION DE SUELOS
Los cultivos sin suelos (hipodrónicos o aeropónicos)son una alternativa imprescendible, que obtimiza los beneficios en el empleo de estructuras que mejoran las condiciones medioambientales, cuyo principal objetivo es eliminar o disminuir los factores limitantes del crecimiento vegetal sustituyendolo por otros soportes de cultivo y aplicando técnicas de fertilización alternativas. Existen variantes más sofisticadas de la aeroponía tradicional como el Schwalbach System (SS) y el Aero-Gro System (AGS), desarrolladas ambas en Australia. La Ciencia de los Sustratos alternativos tiene como base el cultivo de plantas sin utilizar el suelo, de forma que las raíces de las mismas se encuentren suspendidas en un soporte inerte (grava, arena, turba) -lo que se conoce con el nombre de hidroponía-, en la propia disolución nutritiva, lo que exige una recirculación constante de la misma, impidiendo un proceso de anaerobiosis que causaría la muerte inmediata del cultivo-hidroponía pura- o en el interior de una cámara de PVC o cualquier otro material, con las paredes perforadas, por donde se introducen las plantas; en tal caso, las raíces están al aire, crecen en la oscuridad y la disolución nutritiva se destribuye por pulverización a media o baja presión-este sistema recibe el nombre de aeroponía. Enfermedades de las plantas en los cultivos sin suelo: El problema de las enfermedades puede ser diferente o tener distinta extensión en los cultivos sin suelo. Por ejemplo algunos patógenos como Pythium, Phytophthora, cucumber Green Mottle Mosaic Virus y tomapo Mosaic Virusque afectan menos a los cultivos tradicionales pero pueden ser importantes en hidroponía
SISTEMA DE CULTIVOS SIN
SUELOS
•Dependiendo del medio en el que se desarrollan las raíces se pueden clasificar en tres grupos •Cultivos en sustrato: pueden funcionar por inundación periódica del sustrato •Cultivos en agua (hipodropónicos) •Cultivos en aire (aeropónicos): la principal ventaja que aporta es la excelente aireacion que el sistema proporciona a las raíces.
 EJEMPLO DE HIDROPONIA
EJEMPLO DE HIDROPONIALA FERMENTACION
Habrás observado cuando se deja un recipiente con leche sin refrigerar por espacio de uno o dos días, que la composición de ésta cambia, se empieza a formar un sólido (cuajo) y su sabor cambia, se agria, ¿cómo explicarías este fenómeno? Alguna vez haz agregado unas gotas de limón a un vaso con leche, ¿qué sucede? ¿cómo explicarías lo que provoca el jugo de limón?
GUIÓN. Material Sustancias 1 Vaso de precipitados de 1000 mL 1 bureta de 250 mL 1 litro de leche entera 1 mechero bunsen Disolución de Cloruro de calcio al 50 % 1 termómetro de alcohol Agua destilada 2 vasos de precipitados, uno de 250 mL y otro de 50 mL Cloruro de sodio 1 soporte Universal completo cuajo líquido (cuamex) o cuajo de res molido en la licuadora 1 cuchillo Disolución 0.1 M de NaOH 1 m2 de manta Indicador Universal 1 canasta para queso Papel pH 1 cuchara de madera 1 probeta de 100 mL Procedimiento: I. Formación de Queso. 1. Vacía 500 mL de leche en el vaso de precipitados de 1000 mL y calienta a 37 oC durante 5 minutos. 2. Toma 10 mL de la disolución preparada de cloruro de calcio y agrégaselo a la leche, continúa agitando. 3. Agrega de 5 a 7 gotas de cuajo líquido, agita. Suspende el calentamiento 4. Deja reposar por espacio de media hora 5. En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo. 6. Corta la cuajada en trozos aproximadamente de 1 cm2. 7. Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero. 8. Una vez separado el suero del queso, agrégale un poco de cloruro de sodio y mezcla bien. 9. Finalmente pásalo a un recipiente previamente humedecido, espera a que deje de escurrir y estará listo. 10. Toma una porción para realizar el análisis cualitativo de componentes. Preparaciones: • Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada. • Si utilizas cuajo de res lícualo y agrega 25 mL del cuajo molido en 100 mL de agua destilada.

II. Análisis del Suero. Parte A. 1. Introduce un papel pH al suero y anota su valor. ¿qué tipo de sustancia es? 2. Toma 10 mL del suero y vacíalo en un vaso de precipitados de 50 mL, agrégale unas gotas de indicador universal. 3. Coloca una bureta en un soporte universal y llénala de una disolución 0.1 M de NaOH. 4. Procede a titular el suero, agregando gota a gota la disolución valorada de NaOH sobre los 10 mL del suero, conforme agregues la disolución de hidróxido de sodio agita cuidadosamente el vaso con el suero para homogenizarla. 5. En el momento en que la disolución cambie de color a verde, se habrá neutralizado. 6. Anota la cantidad de disolución de hidróxido de sodio que agregaste al vaso 7. Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero. Parte B. -Reconocimiento de glúcidos.
1. Mezcla en un tubo de ensaye 1 mL de solución de Fehling A con 1 mL de Solución de Fehling B. (Reactivo de Fehling) 2. En otro tubo de ensaye pon 1 ml de suero y añade 1 ml de reactivo de Fehling, agita para mezclar y calienta el tubo a baño maría. - Proteínas solubles (Lactalbúmina y lactoglobulina). 1. En un tubo de ensaye agrega 1 mL de hidróxido de sodio al 40% y añade unas 5 gotas de solución de sulfato de cobre 0.01 M y agita. Aparece un color azul. 2. En otro tubo de ensaye pon 1 mL de suero. Vierte sobre de él, el contenido del tubo anterior y agita para que se mezcle. ¿Qué ocurre? - Reconocimiento de la naturaleza Proteica de la Caseína. Recoge con una espátula la porción del queso que separaste (caseína), ponlo en un papel filtro seco, con el mismo papel presiona el sólido hasta que quede bien seco. Reacción Xantoproteica 1. Coloca en un tubo de ensaye una pequeña porción de la caseína lavada y seca, agrégale unas gotas de ácido nítrico y calienta a baño maría por espacio de unos segundos. ¿qué observas? 2. Agrega un mL de hidróxido de amonio, ¿qué observas? Reacción de biuret. 1. Agrega en un tubo de ensaye una porción de caseína y añádela 1 mL de hidróxido `e sodio al 40 % y agita para que se disuelva. 2. Agrega unas gotas de sulfato de cobre 0.01 M. El color violáceo indicará la presencia proteica - Reconocimiento de lípidos. 1. Toma otra porción del sólido y agrégale gotas de éter. Deposítala sobre un trozo de papel filtro limpio. Cuando se evapore el éter aparecerá en el papel una mancha típica de grasa. 2. También se puede vaciar el contenido del tubo en una cápsula de porcelana, colócala en un lugar caliente (al sol) espera a que se evapore el éter, el sólido que queda deberá tener características de las grasas, untuoso al tacto, manchará el papel
OBSERVACIONES: si uno agrga demasido de ña pastilla cuajo, entonces el queso queda como cortado y ya no se puede reparar.
CONCLUSION:ya sea el limon o la pastilla cuajo, el queso cambiara de apariencia y composicion, se agriara y formara solidos, lo que cmprueba la existencia de un aumento de ph.
EL QUESO DESPUES DE SER FILTRADO
EL PAN
PAN
Los alimentos permiten regenerar los tejidos del cuerpo y le suministran energía. Comprenden las sustancias que se han clasificado como glúcidos, grasas, proteínas, minerales y vitaminas. El cuerpo humano está constituido únicamente de los elementos químicos que están contenidos en su alimentación. GUIÓN. Material. 1 Gradilla 1 vidrio de reloj 6 Tubos de ensaye 1 mechero de alcohol Estufa a 90-95oC Pinzas para tubo de ensaye Balanza 3 pipetas Cristalizador Sustancias. Agua destilada Molibdato de amonio al 16% Nitrato de plata 0.1 N Ácido nítrico concentrado Cloruro de bario 1 N Reactivo de Fehlin A y B Nitrato de amonio 1 N Lugol NaOh al 40 % Hidróxido de amonio Sulfato de cobre Parte A. 1. Coloca en un tubo de ensaye un trozo de miga de pan. 2. Con las pinzas calienta en el tubo de ensaye en la llama del mechero, anota tus observaciones. ¿De qué pueden ser las gotas que aparecen en el tubo de en-saye? Parte B. Presencia de Sales en el Pan. Cloruros. 1. Introducir un trozo de pan en un tubo de ensaye 2. Añadir agua destilada que sobre salga aproximadamente un cm. del trozo de pan. 3. Espera de 2 a 3 minutos, agita el tubo de ensaye, y a conti-nuación añade gota a gota nitrato de plata. ¿Qué observas? (precipitado blanco) Fosfatos. 1. Introducir un trozo de miga en otro tubo de ensaye 2. Añade agua destilada suficiente hasta que sobre salga del nivel de la miga. 3. Agitar el tubo `e ensaye y añadir gota a gota una solución de cloruro de bario 1N. ¿Qué observas? (precipitado blanco) o 1. Poner en un tubo de ensaye 1 mL de disolución de molibda-to de amonio al 15%. 2. Añadir 0.5 mL de HNO3 concentrado y 0.5 mL de agua desti-lada, agitar, esta mezcla constituye el reactivo específico del fósforo. 3. Poner en otro tubo de ensaye un trozo de la miga de pan 4. Añadir agua destilada hasta rebasar el nivel del pan (arriba de 2 cm). 5. Añadir 5 gotas de la disolución de nitrato de amonio y poste-riormente 1 mL del reactivo de fósforo preparado anterior-mente. 6. Colocar el tubo a un baño maría (precipitado amarillo) Parte C Análisis de Glúcidos. Azúcares 1. Poner en un tubo de ensaye 1 mL de reactivo de Fehling A y añadir 1 mL de Fehling B 2. Introducir un trozo de miga de pan en el tubo y llevarlo al baño maría. ¿Qué observas? Se observará la reducción del reactivo, debido a la maltosa y glucosa presentes en el pan, formadas por la fermentación del almidón de la harina llevada a cabo por la levadura. Almidón. 1. Pon un trozo de pan en un tubo de ensaye y agrégale 10 mL de agua, caliéntalo a baño maría, cuando esté hirviendo, se verá una especie de engrudo, a contra luz se observará una difusión. 2. En otro tubo prepara el reactivo de Fehling mezclando 2 mL de Fehling con 2 mL de Fehling B. 3. Toma en otro tubo 1 mL del contenido del primer tubo (con el engrudo) y agrégalo al tubo que contiene el reactivo de Fehling, y agrégale de 3 a 4 gotas de lugol, observa qué ocu-rre. Análisis de Lípidos. 1. Tomar un trozo de miga de pan y frotar con ella una hoja de papel blanco: no dejará residuos grasos, con lo que se comprueba la pequeñísima cantidad de estos compuestos en el pan. Análisis de Próti`os 1. Tomar un trozo de miga de pan como un puñado, amasarlo y apretarlo hasta conseguir una bola espesa.
2. Sigue amasándolo debajo de un chorro de agua, poniéndolo debajo un cristalizador cubierto con una malla o gasa, sujeta al recipiente por una liga. 3. Cuando no te quede miga en la mano, se apreciará en la tela o malla una sustancia grisácea, recógela con la espátula y haz con ella dos bolitas e introdúcelas cada una en un tubo de ensaye. 4. En el primer tubo de ensaye añade 1 mL de ácido nítrico y calienta en baño maría. ¿qué observas? 5. Retira el exceso de ácido (vacíalo a un vaso que contenga agua de cal) reteniendo la bolita con la varilla, y echa 1 mL de hidróxido de amonio concentrado. ¿qué observas? 6. En el segundo tubo de ensayo añade 1 mL de NaOH al 40% y 10 gotas de sulfato de cobre 0.1 M- Agita, ¿qué observas?
OBSERVACIONES: en el momento de hacer el filtrado del pan, procura q la malla sea de calidad y con poros muy pequeños
CONCLUSION:sin duda la prescencia de multiples grasas, glucidos(silo e el caso del pan salado)y sales (pan no dulce) es un hecho en el pan.
EN LA IMAGEN , SE OBSERVA EL COLOE DEL PAN, COMPROBANDO LA EXISTENCIA DE GRASAS , GLUCIDOS ETC
COMPOSICION ORGANICA DEL SUELO
La composición orgánica del suelo está constituida por dos componentes, los orgánicos y los inorgánicos. A su vez, la parte orgánica está formada por los residuos de vegetales y animales que se encuentran en diferenpes grados de descomposición, lo que es causado por la presencia de microorganismos. La inorgánica la constituyen el conjunto de minerales que se estudiarán más adelante.
Cuando la mayor parte de la materia orgánica se ha degradado a sus componentes más simples se les nombra HUMUS, el cual es una mezcla de diversas sustancias en las que se integran partículas de diferentes tamaños entre los que se encuentran los coloides. Estos pueden intercambiar iones, ayudan a la formación del suelo y también retienen gran cantidad de agua y de nutrientes. Existen otros microorganismos que se encargan de fijar el nitrógeno del aire atmosférico al suelo, transformándolo en compuestos inorgánicos simples y solubles, por ejemplo, el amoniaco y los nitratos. Estos últimos son absorbidos por las raíces de las plantas para la fabricación de sustancias como las proteínas. 1. Realiza un cuadro comparativo an el que indiques las características representativas de las sustancias orgánicas y de las sustancias inorgánicas. Características. Construye una tabla con las características de cada tipo. Sustancias Orgánicas Sustancias Inorgánicas Se incendia por contener carbono, proviene de material animal,plantas ets XtContienen un ph, para saber el grado de acides, sales binarioas y minerales

DETERMINACIÓN DEL PORCENTAJE DE MATERIA ORGÁNICA. Objetivos. Observar y describir las características de los componentes de la fase sólida del suelo. Calcular el porcentaje de materia orgánica de las cuatro muestras de suelo. Material Sustancias Cápsula de porcelana Balanza 10 g de muestra de suelo Mechero bunsen Pinzas para crisol (4 muestras diferentes de suelo) Soporte universal con anillo y rejilla de asbesto Procedimiento. 1. Pesar 10 g de suelo seco en una cápsula de porcelana. 2. Colocar la cápsula de porcelana en la rejilla del soporte universal, enciende el mechero, y calienta hasta la calcinación (de 15 a 20 minutos). S
Si la muestra de suelo posee un alto contenido de hojarasca, el tiempo se prolongará lo suficiente hasta su total calcinación. 3. Dejar enfriar la mezcla y posteriormente pésala nuevamente, anotando la variación de la masa. 4.XtCalcular el porcentaje de materia orgánica.
OBSERVACIONES:la materia organica es en porcentaje menor q la materia inorganica, la materia organica se puede incendiar facilmente
CONCLUSION:el humus esta integrado por componentes como plamta, y materiales formasdos con carbono
Cuando la mayor parte de la materia orgánica se ha degradado a sus componentes más simples se les nombra HUMUS, el cual es una mezcla de diversas sustancias en las que se integran partículas de diferentes tamaños entre los que se encuentran los coloides. Estos pueden intercambiar iones, ayudan a la formación del suelo y también retienen gran cantidad de agua y de nutrientes. Existen otros microorganismos que se encargan de fijar el nitrógeno del aire atmosférico al suelo, transformándolo en compuestos inorgánicos simples y solubles, por ejemplo, el amoniaco y los nitratos. Estos últimos son absorbidos por las raíces de las plantas para la fabricación de sustancias como las proteínas. 1. Realiza un cuadro comparativo an el que indiques las características representativas de las sustancias orgánicas y de las sustancias inorgánicas. Características. Construye una tabla con las características de cada tipo. Sustancias Orgánicas Sustancias Inorgánicas Se incendia por contener carbono, proviene de material animal,plantas ets XtContienen un ph, para saber el grado de acides, sales binarioas y minerales

DETERMINACIÓN DEL PORCENTAJE DE MATERIA ORGÁNICA. Objetivos. Observar y describir las características de los componentes de la fase sólida del suelo. Calcular el porcentaje de materia orgánica de las cuatro muestras de suelo. Material Sustancias Cápsula de porcelana Balanza 10 g de muestra de suelo Mechero bunsen Pinzas para crisol (4 muestras diferentes de suelo) Soporte universal con anillo y rejilla de asbesto Procedimiento. 1. Pesar 10 g de suelo seco en una cápsula de porcelana. 2. Colocar la cápsula de porcelana en la rejilla del soporte universal, enciende el mechero, y calienta hasta la calcinación (de 15 a 20 minutos). S
Si la muestra de suelo posee un alto contenido de hojarasca, el tiempo se prolongará lo suficiente hasta su total calcinación. 3. Dejar enfriar la mezcla y posteriormente pésala nuevamente, anotando la variación de la masa. 4.XtCalcular el porcentaje de materia orgánica.
OBSERVACIONES:la materia organica es en porcentaje menor q la materia inorganica, la materia organica se puede incendiar facilmente
CONCLUSION:el humus esta integrado por componentes como plamta, y materiales formasdos con carbono
COMPONENTES INORGANICOS DEL SUELO
Objetivos: Señalará cuales son los cationes y aniones más comunes que están presentes en la parte inorgánica del suelo. Reconocerá que los compuestos inorgánicos se clasifican óxidos, hidróxidos, ácidos y sales. Aplicará el concepto ion a la composición de sales. Clasificará a las sales en carbonatos, sulfatos, nitratos, fosfatos, cloruros y silicatos.
Procedimiento:
1. Extracción acuosa de la muestra de suelo.
Pesa 10 g de suelo previamente seca al airey tamízalo a través de una malla de 2 mm. Introduce la muestra en un matraz y agrega 50 mL de agua destilada. Tapa el matraz y agita el contenido de 3 a 5 minutos. Filtra el extracto, y en caso de que éste sea turbio, repite la operación utilizando el mismo filtro. Al concluir la filtración tapa el matraz.
IDENTIFICACIÓN DE ANIONES 2. Identificación de cloruros (Cl-1). Reacción Testigo: en un tubo de ensaye coloca 2 mL de agua destilada y agrega algunos cristales de algún cloruro (cloruro de sodio, de potasio, de calcio, etc.). Agita hasta disolver y agrega unas gotas de solución de AgNO3 0.1N (nitrata de plata al 0.1 N). Observarás la formación de un precipitado blanco, que se ennegrecerá al pasar unos minutos. Esta reacción química es característica de este ión. Muestra de suelo: en un tubo de ensayo coloca 2 mL del filtrado. Agrega unas gotas de ácido nítrico diluido hasta eliminar la efervescencia. Agrega unas gotas de solución de AgNO3 0.1N. Compara con tu muestra testigo. 3. Identificación de Sulfatos (SO4-2). Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfato (sulfato de sodio o de potasio) Agrega unas gotas de cloruro de bario al 10%. Observarás una turbidez, que se ennegrecerá al pasar unos minutos. Muestra del suelo: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona unas gotas de cloruro de bario al 10 %. Compara con tu muestra testigo. 4. Identificación de Carbonatos (CO3-2). Reacción testigo: en un vidrio de reloj, coloca un poco de carbonato de calcio y adiciona unas gotas de ácido clorhídrico diluido. Observarás efervescencia por la presencia de carbonatos. Muestra de suelo: en un vidrio de reloj, coloca un poco de muestra de suelo seco. Adiciona unas gotas de ácido clorhídrico diluido. Compara con la muestra testigo. 5. Identificación de sulfuros (S-2) Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfuro. Adiciona unas gotas de cloruro de bario al 10% y un exceso de ácido clorhídrico. Observarás que se forma una turbidez, que con el paso del tiempo se ennegrecerá. Reacción muestra: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona tres gotas de cloruro de bario al 10 % y un exceso de ácido clorhídrico. Compara con tu muestra testigo. 6. Identificación de nitratos (NO3-1). Reacción testigo: un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún nitrato (de sodio por ejemplo), y agita para disolver. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado.
 ALGUNOS MINERALES
ALGUNOS MINERALES
PRECAUCIÓN: ESTA REACCIÓN ES FUERTEMENTE EXOTÉRMICA. Evita agitación innecesaria. Deja reposar unos minutos y observa la formación de un anillo café. Reacción muestra: coloca 2 mL de filtrado del suelo en un tubo de ensayo. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado. Sigue las indicaciones de la muestra testigo y compárala.
IDENTIFICACIÓN DE CATIONES 7. Identificación de Calcio (Ca+2). Introduce un alambre de nicromel en el extracto de suelo y acércalo a la flaia del mechero bunsen. Si observas una flama de color naranja, indicará la presencia de este catión. 8. Identificación de Sodio (Na+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Disuelve la muestra con 5 mL de solución de ácido clorhídrico (1:1). Introduce el alambre de nicromel y humedécelo en la solución, llévalo a la flama del mechero, si espa se colorea de amarillo indicará la presencia de iones sodio. 9. Identificación de Potasio (K+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Agrega 20 mL de acetato de sodio 1N y agita 5 minutos. Filtra la suspensión, toma un alambre de nicromel, humedécelo en esta suspensión y llévalo a la flama del mechero bunsen. Si hay presencia de iones potasio se observa
una flama de color violeta.
 CATIONES DEL SUELO
CATIONES DEL SUELO
IDENTIFICACIÓN DE ANIONES 2. Identificación de cloruros (Cl-1). Reacción Testigo: en un tubo de ensaye coloca 2 mL de agua destilada y agrega algunos cristales de algún cloruro (cloruro de sodio, de potasio, de calcio, etc.). Agita hasta disolver y agrega unas gotas de solución de AgNO3 0.1N (nitrata de plata al 0.1 N). Observarás la formación de un precipitado blanco, que se ennegrecerá al pasar unos minutos. Esta reacción química es característica de este ión. Muestra de suelo: en un tubo de ensayo coloca 2 mL del filtrado. Agrega unas gotas de ácido nítrico diluido hasta eliminar la efervescencia. Agrega unas gotas de solución de AgNO3 0.1N. Compara con tu muestra testigo. 3. Identificación de Sulfatos (SO4-2). Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfato (sulfato de sodio o de potasio) Agrega unas gotas de cloruro de bario al 10%. Observarás una turbidez, que se ennegrecerá al pasar unos minutos. Muestra del suelo: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona unas gotas de cloruro de bario al 10 %. Compara con tu muestra testigo. 4. Identificación de Carbonatos (CO3-2). Reacción testigo: en un vidrio de reloj, coloca un poco de carbonato de calcio y adiciona unas gotas de ácido clorhídrico diluido. Observarás efervescencia por la presencia de carbonatos. Muestra de suelo: en un vidrio de reloj, coloca un poco de muestra de suelo seco. Adiciona unas gotas de ácido clorhídrico diluido. Compara con la muestra testigo. 5. Identificación de sulfuros (S-2) Reacción testigo: en un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún sulfuro. Adiciona unas gotas de cloruro de bario al 10% y un exceso de ácido clorhídrico. Observarás que se forma una turbidez, que con el paso del tiempo se ennegrecerá. Reacción muestra: en un tubo de ensayo coloca 2 mL de filtrado. Adiciona tres gotas de cloruro de bario al 10 % y un exceso de ácido clorhídrico. Compara con tu muestra testigo. 6. Identificación de nitratos (NO3-1). Reacción testigo: un tubo de ensayo coloca 2 mL de agua destilada y agrega unos pocos cristales de algún nitrato (de sodio por ejemplo), y agita para disolver. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado.
 ALGUNOS MINERALES
ALGUNOS MINERALESPRECAUCIÓN: ESTA REACCIÓN ES FUERTEMENTE EXOTÉRMICA. Evita agitación innecesaria. Deja reposar unos minutos y observa la formación de un anillo café. Reacción muestra: coloca 2 mL de filtrado del suelo en un tubo de ensayo. Añade gota a gota H2SO4 3M, hasta acidificar (verificar acidez con papel tornasol) Agrega 2 mL de solución saturada de FeSO4. Inclina el tubo aproximadamente a 45º y añade despacio y resbalando por las paredes 1 mL de H2SO4 concentrado. Sigue las indicaciones de la muestra testigo y compárala.
IDENTIFICACIÓN DE CATIONES 7. Identificación de Calcio (Ca+2). Introduce un alambre de nicromel en el extracto de suelo y acércalo a la flaia del mechero bunsen. Si observas una flama de color naranja, indicará la presencia de este catión. 8. Identificación de Sodio (Na+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Disuelve la muestra con 5 mL de solución de ácido clorhídrico (1:1). Introduce el alambre de nicromel y humedécelo en la solución, llévalo a la flama del mechero, si espa se colorea de amarillo indicará la presencia de iones sodio. 9. Identificación de Potasio (K+1). Coloca 1 g de suelo seco y tamizado en un tubo de ensayo. Agrega 20 mL de acetato de sodio 1N y agita 5 minutos. Filtra la suspensión, toma un alambre de nicromel, humedécelo en esta suspensión y llévalo a la flama del mechero bunsen. Si hay presencia de iones potasio se observa
una flama de color violeta.
 CATIONES DEL SUELO
CATIONES DEL SUELOMUESTRAS DE SUELOS
PROPIEDADES FÍSICAS
Propiedad ¿Cómo medirla?
Densidad
1. Para medir la masa de una muestra de tierra, se coloca ésta en una balanza (utiliza un vidrio de reloj o cápsula de porcelana) para colocarla en el platillo de la balanza.
2. Para determinar el volumen de la muestra de suelo, una vez medida su masa en la balanza, se hace por medio de desplazamiento de agua (considerando que la tierra es un sólido insoluble en ésta.
3. Volumen por desplazamiento de agua. En una probeta agrega 20 o 30 mL de agua (dependiendo de la cantidad de tierra que hayas medido su masa) y posteriormente agrega la tierra, el aumento en el nivel del agua corresponde al volumen de la tierra.
4. Volumen agua + Volumen de tierra = V2
Entonces Volumen de tierra = V2 - Volumen de agua
Así
% Humedad Indica la cantidad de agua que existe en el suelo (tipo de tierra) expresada en porcenta-je.
1. Mide la masa de una muestra de suelo en una balanza; en una cápsula o crisol de por-celana. Recuerda medir previamente la MASA DE LA CÁPSULA O CRISOL, para restarle posteriormente su valor. (masa inicial)
2. Como se requiere conocer la cantidad de agua que contiene el suelo, necesitamos eliminar ésta de la muestra, por ello, debemos calentar hasta lograrlo, para tener un calentamiento homogéneo utilizamos una estufa o mufla, el tiempo necesario depen-diendo del tamaño de muestra.
3. Una vez eliminada el agua de la mezcla, procedemos a medir la masa nuevamente (masa final).
4. A ambos valores de masa hay que restar el valor de la masa de la cápsula o crisol.
Entonces:
Masa de agua = masa inicial - masa final
% Humedad será:
Masa inicial - 100%
Masa agua - X % X% = % Humedad
Cantidad de Aire en el Suelo
% Aire
(Porosidad) La cantidad de aire que contiene un tipo de suelo, depende del tamaño de partículas que posea la mezcla. Por el tamaño de éstas partículas se tiene mayor o menor porosidad, y por lo tanto tendremos mayor o menor cantidad de aire entre éstas.
Para medirlo tenemos que:
1. Medir en una probeta de 50 o 100 mL completamente seca, el volumen de una muestra de suelo.
2. Medir en una probeta de 50 o 100 mL completamente seca, el volumen de una muestra de suelo.
3. En otra probeta de 50 o 100 mL agregar 30 mL de agua.
4. Vaciar la tierra (una vez que hayas medido su volumen) a la probeta que contiene el agua, observaras que el nivel del líquido cambia y salen algunas burbujas de aire.
Así, tenemos volumen de tierra seca (V1), volumen de agua (V2) y volumen de agua con tierra (V3), entonces:
Si V3 - V2 = Volumen de aire
Volumen de tierra seca - 100%
Volumen de aire - Y% Y% = % Aire
Propiedad ¿Cómo medirla?
Solubilidad Esta propiedad no la determinaremos por cada uno de los componenpes de la mezcla de suelo, nos abocaremos a considerar en cada muestra que hay materia que es soluble en agua y otra que no lo es (sin considerar cuantas sustancias lo son y cual es su valor de solubilidad)
Por lo tanto consideraremos que tendremos un porcentaje en masa de materia soluble y de materia insoluble, entonces determinaremos:
1. Medir la masa de una muestra de suelo (M1), en una cápsula de porcelana (a la cual previamente tendrás que determinar su masa)
2. Agregar agua y agitar la mezcla para ayudar a disolver a las sustancias solubles.
3. Filtrar la mezcla y recoger el filtrado en la cápsula de porcelana limpia.
4. Evaporar el agua del filtrado hasta la cristalización de alguna sustancia.
5. Dejar enfriar y medir nuevamente la masa del contenido de la cápsula (M2)
Entonces:
Cantidad de sustancias solubles = M2
Cantidad de sustancias Insolubles = M1 - M2
M1 - 100%
M2 - Z% Z% = % de materia soluble en la muestra
Observaciones:
En toda actividad tenemos que fijarnos lo que ocurre en cada uno de los procedimientos que seguimos e irlos anotando, para tener registrados todos aquellos cambios o alteraciones de lo que estamos haciendo. Es reco-mendable registrar todas aquellas observaciones que nos permitan argumentar si lo realizado esta bien hecho o tendríamos que hacer modificaciones a nuestro procedimiento.
Análisis.
En todas las activida`es deberás hacer un análisis que consiste en una revisión, tanto de las observaciones reali-zadas, así como, de los datos y/o resultados que haz obtenido para cotejar, comparar y examinar el comporta-miento de lo que se pretende en la experimentación. Este análisis permitirá contar con elementos que sirvan para justificar y aprobar la (s) hipótesis planteadas.
Por ello, en esta actividad experimental tendrás que analizar los resultados de las propieda`es físicas de cada una de las muestras de suelo, compararlas con el resto de estas muestras y considerar por ello, las característi-cas que tiene cada tipo de suelo de las muestras analizadas.
Suscribirse a:
Entradas (Atom)



